Лечащий Врач #09, 2009
Развитие принципов доказательной медицины в области клинического питания: новые клинические рекомендации
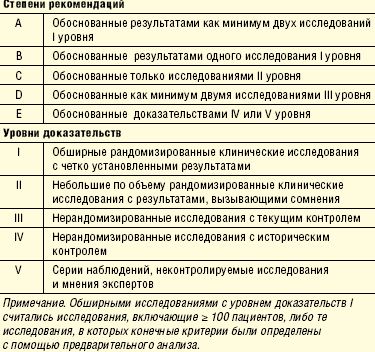
Питание больных в критических состояниях до настоящего времени является разделом интенсивной медицины, испытывающим существенный недостаток стандартизации. В отличие от детально структурированных алгоритмов посиндромного лечения больных отделений интенсивной терапии, а также значительного разнообразия протоколов и стандартов реанимационной помощи, нутритивная поддержка все еще далека от единого методического подхода. Несмотря на большое разнообразие публикаций по данной теме, их данные весьма противоречивы, а исследования, выполненные с высоким уровнем доказательности, весьма немногочисленны. С другой стороны, повседневная клиническая практика ежедневно ставит актуальные вопросы клинического питания, включая показания к энтеральному и парентеральному питанию (ПП), преимущества/недостатки энтерального питания (ЭП), критерии выбора энтеральных смесей, вопросы техники их введения и оценки переносимости. Эти и некоторые другие проблемы детально рассмотрены в новых клинических рекомендациях SCCM (Society of Critical Care Medicine) и ASPEN (American Society for Parenteral and Enteral Nutrition) по нутритивной поддержке взрослых пациентов в критических состояниях [Mc Clave S. A., Martindale R. G., Vanek V. W. et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutririon (ASPEN)//Journal of Parenteral and Enteral Nutrition. 2009. V. 33, № 3, p. 277–316]. Основные положения данного документа приведены ниже. Они отражают современное состояние технологий ЭП, часть из которых широко применяется в отечественной практике, однако немалая доля требует безотлагательного внедрения. Система доказательств, принятая в данных клинических рекомендациях, приводится в табл. Ссылки на публикации приводятся частично. Полный библиографический список имеется в редакции.
Начало ЭП
Традиционные показатели состояния питания (альбумин, преальбумин и антропометрия) оказываются не пригодными в критических состояниях. Перед началом нутритивной поддержки состояние питания должно быть оценено согласно потере веса, предшествующему потреблению нутриентов, оценке тяжести заболевания, сопутствующих состояний и функции желудочно-кишечного тракта (уровень E; Martindale R. G., Maerz L. L., 2006).
Нутритивную поддержку путем ЭП следует начинать для пациента в критическом состоянии, который не способен питаться самостоятельно (уровень С; Schroeder D. et al., 1991). ЭП является предпочтительным путем питания по сравнению с ПП для пациента в критическом состоянии, который требует нутритивной поддержки (уровень В; Braga et al., 2001; Petrov et al., 2006; Eckerwall et al., 2006). ЭП следует начинать рано, в первые 24–48 часов после поступления больного в реанимационное отделение (уровень С; Heyland D. K. et al., 2003). Питание следует расширять в последующие 48–72 часа (уровень Е; Heyland D. K. et al., 2003).
В условиях гемодинамической нестабильности пациентов, получающих высокие дозы вазопрессоров в комбинации с обширным объемом жидкости или продуктов крови, ЭП следует приостанавливать до момента стабилизации состояния пациента (уровень Е; Zaloga G. P. et al., 2003). Для пациентов реанимационных отделений наличие звуков перистальтики кишечника, отхождение газов и стула не являются необходимыми симптомами для начала ЭП (уровень В; Dvorak M. F. et al., 2004).
В условиях реанимационного отделения приемлемо питание как через внутрижелудочный зонд, так и через назоеюнальный. Больным в критических состояниях следует питаться с помощью энтерального доступа (с расположением зонда в тонком кишечнике) в связи с высоким риском аспирации или при появлении признаков непереносимости интрагастрального питания (уровень С; Lien H. C. et al., 2000).
Вынужденный отказ от ЭП из-за упорно сохраняющегося остаточного объема пищи в желудке сам по себе может быть достаточной причиной для изменения положения зонда на назоеюнальное (уровень Е; Ho K. M. et al., 2006).
Дозирование ЭП
Попытки обеспечить > 50–65% долженствующей калорийности питания следует предпринимать за счет энтеральных смесей в течение первой недели госпитализации (уровень С; Taylor S. J. et al., 1999).
Если невозможно обеспечить энергетические потребности (100% долженствующей калорийности) после 7–10 дней исключительно ЭП, то необходимо принять во внимание начало дополнительного ПП (уровень Е; Braunschweig C. L. et al., 2001). Начало дополнительного ПП ранее указанного 7–10-дневного периода у пациента, уже получающего ЭП, не улучшает исход и может нанести ему вред (уровень С; Bauer P., 2000).
У пациентов с индексом массы тела (ИМТ) < 30 потребность в белке должна составлять 1,2–2,0 г/кг фактической массы тела в сутки и выше (у больных с ожогами или сочетанными травмами) (уровень С; Stroud M. et al., 2007). У пациентов в критических состояниях, страдающих ожирением, рекомендуется гипокалорийное питание энтеральными смесями. Для всех видов ожирения при ИМТ > 30, доля ЭП не должна превышать 60–70% целевых энергетических потребностей или 11–14 ккал/кг фактической массы тела в сутки (или 22–25 ккал/кг идеальной массы тела в сутки). Белок должен обеспечиваться на суточном уровне ≥ 2,0 г/кг (ИМТ 30–40) и ≥ 2,5 г/кг (ИМТ ≥ 40) идеальной массы тела (уровень D; Choban D. E., 2005).
Мониторинг толерантности и адекватности ЭП
Период времени, когда пациент не принимает перорально ни пищу, ни жидкость (nil per os, NPO) до, во время и сразу же после проведения диагностических тестов или процедур должен быть минимизирован, чтобы предотвратить неадекватное поступление нутриентов и пролонгированные периоды кишечной непроходимости (илеуса). Илеус может провоцироваться посредством NPO-статуса (уровень С; McClave S. A., 1999). Пациенты, получающие ЭП, должны быть оценены в отношении риска аспирации (уровень Е; McClave S. A., 2002).
Следующие мероприятия показаны для снижения риска аспирации:
-
у всех интубированных пациентов реанимационных отделений, получающих ЭП, голова должна быть приподнята на 30–45 градусов (уровень С; Drakulovic M. B., 2002);
-
для пациентов высокого риска или у больных, имеющих признаки интолерантности к назогастральному питанию, проведение ЭП следует переключать на продленную инфузию (уровень D; Steevens E. C., 2002);
-
агенты, усиливающие моторику кишечника (такие прокинетики, как метоклопрамид, эритромицин, или антагонисты опиоидных рецепторов — налоксон) следует назначать, когда это клинически выполнимо (уровень С; Booth C. M. et al., 2002; Yavagal D. R., 2000);
-
cледует признать желательным постпилорическое расположение зонда (уровень С; Heyland D. K. et al., 2001);
-
обработку полости рта хлоргексидином 2 раза в день следует проводить для снижения риска вентилятор-ассоциированной пневмонии (уровень С; Houston S., 2002).
Выбор смеси для ЭП
Иммуномодулирующие смеси для ЭП (содержащие аргинин, глютамин, нуклеиновые кислоты, омега-3 жирные кислоты и антиоксиданты) следует использовать для следующих категорий пациентов:
-
обширные хирургические вмешательства;
-
травма;
-
ожоги;
-
опухоли головы и шеи;
-
больные в критических состояниях на ИВЛ, с особой осторожностью — у пациентов с тяжелым сепсисом;
-
для хирургических больных — уровень А (Beale R. J. et al., 1999);
-
для терапевтических больных — уровень В (Montejo J. C., 2001).
Пациенты отделений интенсивной терапии, не отвечающие критериям для назначения иммуномодулирующих смесей, должны получать стандартные энтеральные смеси (уровень В; Сonsensus recommendations from the US summit on immune-enhancing enteral therapy; JPEN, 2001).
Пациенты с острым респираторным дистресс-синдромом и тяжелой дыхательной недостаточностью должны получать энтеральные смеси, характеризующиеся противовоспалительным липидным профилем (например, наличием омега-3 жирных кислот) и содержанием антиоксидантов (уровень А; Singer P., 2006).
Для получения оптимального терапевтического эффекта от применения иммуномодулирующих смесей, не менее 50–65% потребности в энергии должно быть обеспечено за их счет (дозозависимый эффект) (уровень С; Bower R. H., 1995).
При признаках диареи могут использоваться смеси, содержащие растворимые волокна, или пептидные смеси (уровень Е; Edes T. E., 1990).
Дополнительная терапия
Применение пробиотиков показало улучшение клинических исходов (чаще всего связанное со снижением инфекций) для специфических групп больных в критических состояниях, включая трансплантацию, обширные вмешательства на органах брюшной полости и тяжелые травмы (уровень С; Rayes N., 2002).
Однако в настоящее время не могут быть даны клинические рекомендации к использованию пробиотиков для всех категорий реанимационных больных в целом. Также не могут быть даны рекомендации для использования пробиотиков у больных с тяжелым острым некротизирующим панкреатитом, в связи с разноречивостью данных литературы и гетерогенностью использованных бактериальных штаммов.
Сочетание витаминов антиоксидантного действия (включая витамин Е и аскорбиновую кислоту) с микроэлементами (в особенности с селеном, цинком и медью) следует обеспечивать всем больным в критических состояниях, получающим специализированную нутритивную терапию (уровень В; Nathens A. B., 2002).
Добавление энтерального глютамина в режиме ЭП (к смесям без супплементации глютамином) показано при ожогах, травмах и для различных категорий пациентов отделений реанимации (уровень В; Hall J. C. et al., 2003).
Растворимая клетчатка (soluble fiber) может быть показана больным полностью реанимированным, гемодинамически стабильным, находящимся в критических состояниях, получающим ЭП, у которых развилась диарея. Нерастворимая клетчатка должна быть исключена у всех пациентов, находящихся в критических состояниях. Как растворимую, так и нерастворимую клетчатку следует исключать из питания пациентов с высоким риском ишемии кишечника или тяжелыми нарушениями моторики кишечника (уровень С; Scaife C. L., 1999).
Дыхательная недостаточность
Специальные высоколипидные низкокарбогидратные смеси не рекомендованы для рутинного применения у пациентов реанимационных отделений с острой дыхательной недостаточностью (уровень Е; Al-Saadi N. M. et al., 1989).
Калорически плотные смеси следует применять у пациентов с острой дыхательной недостаточностью (уровень Е; Barale F., 1990).
Уровень фосфатов сыворотки крови должен тщательно мониторироваться и возмещаться, когда это необходимо (уровень Е; Mizock В. А., 2000).
Почечная недостаточность
Пациенты с острой почечной недостаточностью (ОПН) должны получать стандартные энтеральные смеси и иметь стандартные потребности в белке и калориях. Если имеются значительные электролитные нарушения, то могут использоваться специальные смеси, предназначенные для больных с почечной недостаточностью (с соответствующим электролитным профилем) (уровень Е; Cano N. et al., 2006).
Пациенты на гемодиализе или продленной почечной заместительной терапии должны получать повышенное количество белка, максимум 2,5 г/кг/сутки. Белок не следует ограничивать у больных с почечной недостаточностью в целях избежания или отсрочки диализной терапии (уровень С; Wooley J. A. et al., 2005).
Острый панкреатит
При поступлении должна быть проведена оценка тяжести острого панкреатита. Больным с тяжелым острым панкреатитом необходима постановка тонкокишечного зонда и начало ЭП, как только завершено восполнение объема жидкости (уровень С; Olah А., 2002).
Пациенты с легкими и среднетяжелыми вариантами острого панкреатита не должны получать нутритивную поддержку (если только не развиваются непредвиденные осложнения или безуспешны попытки перейти к питанию per os в течение 7 дней) (уровень С; Sax H. C. et al., 1997).
Пациенты с тяжелым панкреатитом могут получать ЭП внутрижелудочно или еюнально (уровень С; Kumar A. et al., 2006).
Толерантность (переносимость) ЭП у больных с тяжелым острым панкреатитом может быть повышена следующими мерами:
-
минимизация периода илеуса после поступления при помощи раннего начала ЭП (уровень С; Сravo M., 1989);
-
смещение уровня инфузии ЭП дистальнее по ходу ЖКТ (уровень C; McClave S. A. et al., 1997);
-
переход с болюсного введения ЭП на продленную инфузию (уровень С; Harsanyi L., 1992);
-
замена смесей для ЭП, содержащих цельный белок, на пептидные смеси, а также вместо длинноцепочечных жирных кислот — среднецепочечные триглицериды или элементные смеси с низким содержанием жира (уровень Е; Grant J. P., 1987).
Е. В. Полевиченко, доктор медицинских наук, профессор Ростовский государственный медицинский университет, Ростов-на-Дону
