Лечащий Врач #02, 2009
Бактериальный вагиноз: место пероральной пробиотической терапии
Общая численность микроорганизмов, заселяющих различные органы человека, достигает порядка 1015, т. е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма. Значительная часть (более 60%) микрофлоры заселяет различные отделы желудочно-кишечного тракта, примерно 15% приходится на ротоглотку, на урогенитальный тракт — 11%(из них на вагинальный отдел — 9%), 14% — на кожные покровы. Одновременная эволюция организма хозяина и микроорганизмов благодаря двунаправленному обмену способствовала закреплению взаимовыгодных коллективных взаимодействий. Резидентные микроорганизмы, взаимодействующие с человеком на протяжении тысячелетий, контактируют с толл-подобными рецепторами (toll-like receptors (TLR)) слизистых оболочек пищеварительного тракта. Активация TLR влияет на секрецию цитокинов мукоцитами, воздействуя, таким образом, на дальнейший процессинг и презентацию антигенов бактерий клеткам хозяина, выработку и секрецию иммуноглобулина А, связанного с секреторным компонентом лизоцима, лактоферрина и других биологически активных веществ.
Взаимодействие между физиологической микрофлорой и организмом хозяина происходит на поверхности слизистых оболочек, из которых самой большой по площади является слизистая оболочка кишечника.
Попытки воздействовать на кишечный биоценоз и через него — на здоровье человека имеют долгую историю. Еще И. И. Мечников в 1910 г. предлагал использовать кисломолочные продукты для омоложения и продления жизни.
Сегодня фармацевтический рынок предлагает практическому врачу широкий спектр лекарственных средств, способствующих нормализации микробиоценоза толстой кишки. Все средства, положительно влияющие на состав кишечной микрофлоры, можно разделить на пробиотики, пребиотики и синбиотики.
Пробиотики представляют собой гетерогенную группу непатогенных бактерий. С 30-х годов прошлого столетия ведут отсчет препараты, содержащие лактобактерии и бифидобактерии, так называемые пробиотики. В соответствии с определением рабочей группы ВОЗ к ним относят живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина.
Препараты, входящие в группу пробиотиков, должны соответствовать следующим требованиям:
-
соответствие здоровой микрофлоре человека;
-
высокая жизнеспособность и биологическая активность;
-
антагонизм по отношению к условно-патогенной и патогенной флоре;
-
устойчивость к физико-химическим факторам (кислотность, осмотический шок, температура, действие желчных кислот и т. п.);
-
антибиотикоустойчивость;
-
наличие в препарате симбионтных штаммов.
В ходе международного конгресса гастроэнтерологов (Монреаль, 2005 г.) было дано определение пробиотиков как препаратов на основе кишечных комменсалов, способных осуществлять биологический контроль в организме и обладающих регуляторными, триггерными свойствами. Такой биологический потенциал пробиотиков объясняется многочисленными метаболическими эффектами энтеральной микрофлоры, включая синтез витаминов В и К, короткоцепочечных жирных кислот, инактивацию пищевых канцерогенов, бактериальную ферментацию некоторых лекарственных препаратов, синтез сигнальных молекул и др.
К пробиотикам относят такие препараты, как Линекс, Энтерол, Бактисубтил, Бифидумбактерин, Лактобактерин и др. Пробиотики подразделяются по количеству входящих в состав препарата культур на монокомпонентные (Бифидумбактерин, Энтерол, Бактисубтил и т. д.) и поликомпонентные (Линекс), а также по свойству пробиотической культуры на самоэлиминирующиеся антагонисты (Энтерол, Бактисубтил) и на бифидосодержащие, лактосодержащие и колисодержащие. Например, препарат Линекс относится к поликомпонентным бифидо- и лактосодержащим пробиотикам, так как в его состав входят три микроорганизма — Bifidobacterium infantis, Lactobacillus acidophilus и Enterococcus faecium. Комбинированные пробиотики отличаются большей эффективностью в сравнении с монокомпонентными: лактобактерии и энтерококк преимущественно колонизируют тонкую кишку, а бифидобактерии — толстую, поэтому пробиотические культуры наиболее физиологично поддерживают колонизационную резистентность и способствуют выполнению функций индигенной кишечной микрофлоры.
Пребиотики представляют собой стабилизаторы среды обитания и стимуляторы роста нормальной микрофлоры. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством — стимулировать рост и развитие нормальной микрофлоры кишечника. К пребиотикам относят лактулозу, глюкозу, протеины, камедь, аминокислоты, витамины и минералы, каолин, пищевые волокна, инулин и олигофруктозу.
Комбинированные средства, сочетающие в себе как про-, так и пребиотический компоненты, относят к синбиотикам (например, Линекс Био).
Действие пероральной пробиотической терапии не сводится к простому заселению кишечника, как это зачастую представляется. Их влияние более сложно и многопланово. Это и конкуренция с патогенной и условно-патогенной микрофлорой; адгезия к слизистой оболочке кишечника и взаимодействие с эпителиоцитами; иммуномодулирующий эффект. Микробные липополисахариды и гликопептиды пробиотической флоры взаимодействуют с TLR с последующей передачей стимулирующего импульса на белок NFkB, вследствие чего последний транспортируется в ядро клетки. Активация NFkB приводит к переключению дифференцировки Th0-лимфоцитов на Thl-путь и стимуляции выработки провоспалительных цитокинов. Пробиотические штаммы лактобактерий (LGG, L. acidophylus), E. faecium, Str. thermophylus воспринимаются TLR и стимулируют ответ хозяина, усиливая выработку Th1 и IL-1, INF-альфа. Они стимулируют фагоцитарную активность нейтрофилов и выработку sIgА. В то же время бифидобактерии оказывают стимулирующее воздействие на Th-reg и, соответственно, выработку TGF-бета, IL-10, способствуя формированию иммунологической толерантности. Этот процесс сопровождается снижением синтеза IgE и усилением синтеза sIgA. Наиболее активно повышают уровень IL-10 В. longum, B. bifidum, B. infantis. Пробиотики, в состав которых входят симбионтные штаммы бактерий, аэробы и анаэробы, вероятно, могут оказывать более многоплановое и мощное иммуномодулирующее действие, чем монокомпонентные препараты.
Иммунорегулирующее действие пробиотиков расширяет возможности их использования и раскрывает широкие перспективы для применения в разных клинических ситуациях. Например, с позиций гастроэнтеролога эффективность пробиотических средств изучается в лечении заболеваний, ассоциированных с инфекцией Helicobacter pylori, воспалительных заболеваний кишечника, диффузных заболеваний печени, а также функциональной патологии кишечника. Мы имеем собственный опыт применения поликомпонентного пробиотика Линекс в лечении пациентов с язвенной болезнью, ассоциированной с инфекцией H. pylori. Эффективность включения Линекса в качестве препарата сопровождения к стандартной эрадикационной терапии тестировалась в открытом когортном проспективном рандомизированном (метод простой рандомизации с помощью конвертов) исследовании с включением 30 пациентов. Полученные нами данные свидетельствуют, что комбинация стандартной антихеликобактерной терапии с пробиотиком существенно снижает частоту развития синдрома кишечной диспепсии посредством протективного действия в отношении кишечного микробиоценоза, повышает приверженность пациентов к лечению и, таким образом, способствуют эрадикации инфекта.
Иммуногенный потенциал пробиотических средств привлекает внимание не только специалистов-гастроэнтерологов, но и врачей других специальностей, являясь отражением необходимости междисциплинарного подхода к восстановлению микроэкологического статуса макроорганизма. Так, проблема лечения и профилактики рецидивирующего бактериального вагиноза все чаще заставляет искать возможности восстановления физиологической микрофлоры влагалища путем нормализации кишечного биотопа для достижения адекватного функционирования местного иммунного ответа слизистых оболочек.
Бактериальный вагиноз — общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа и сопровождающийся чрезмерно высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов и резким снижением или отсутствием молочнокислых бактерий в отделяемом влагалища. Трудности в курации пациенток с бактериальным вагинозом определяются нередким сочетанием с папилломавирусной инфекцией (ПВИ) гениталий у женщин и другими инфекциями, передаваемыми половым путем (ИППП). Восстановление микробиоценоза влагалища уменьшает риск ИППП, и способствует улучшению репродуктивного здоровья и качества жизни женщин.
Пероральная терапия пробиотиками в лечении бактериального вагиноза
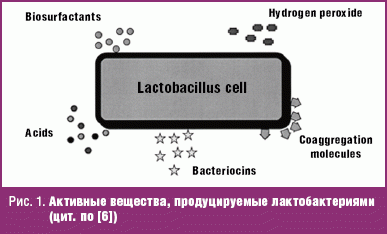
Предпосылкой к разработке схем терапии бактериального вагиноза с включением в антибактериальную терапию приема пробиотических культур послужило появление доказательств об эффективности определенных штаммов пробиотических культур при прямом введении во влагалище или когда они восходят из прямой кишки после перорального приема, а также благодаря их иммуногенному потенциалу. Как минимум для двух штаммов лактобактерий (Lactobacullus rhamnosus GR-1 и L. fermentum RC-1) доказана возможность колонизации влагалища восходящим путем. Основной акцент в отношении лактобактерий сделан в связи с тем, что именно лактобациллы доминируют в микробном пейзаже влагалища. Эти физиологические бактерии продуцируют кислоты, бактериоцины, перекись кислорода, биосульфактанты, препятствуют колонизации патогенной и грибковой флоры (рис. 1).
Результаты проведенных контролируемых исследований подтверждают положительный эффект применения пробиотиков, в том числе и перорально, при бактериальном вагинозе, рецидивирующих инфекциях мочеполового тракта и вульвовагинальном кандидозе у женщин. В 2007 году был опубликован систематизированный обзор, включивший результаты адекватных контролируемых исследований, посвященных оценке эффективности пробиотической терапии в лечении больных бактериальным вагинозом. Результаты клинических исследований с пероральным приемом пробиотиков разнились в зависимости от стартового фона микробиоценоза (не только влагалища, но и кишечника), наличия сопутствующей соматической патологии, а также вида назначенных пробиотических культур. Вместе с тем была отмечена эффективность, статистически достоверно превышающая эффект плацебо, перорального приема культур L. аcidophilus, L. rhamnosus GR-1, L. fermentum RC-14 при условии их приема от 14 дней до 2 месяцев в лечении бактериального вагиноза.
Эффективность пробиотических культур, содержащих лактобактерии, в качестве средств сопровождения к антибактериальной терапии, статистически достоверно выше плацебо и составляет от 60% (р = 0,004) до 88% (р < 0,005) при условии приема лактобактерий не менее 14 дней.
Пробиотическая терапия как сопровождение к антибактериальной терапии при бактериальных вагинозах рассматривается сегодня не только с позиций купирования бактериального вагиноза, но и с позиций профилактики последующего обострения при рецидивирующем течении заболевания. Связано это с тем, что при бактериальных вагинозах назначаются антибактериальные средства, которые уменьшают число не только патогенной флоры, но и физиологической, что в свою очередь сопровождается риском рецидива вагиноза.
Систематизированный обзор, опубликованный в 2008 году, обобщил опыт применения пробиотических культур в профилактике рецидивов урогенитальных инфекций. По результатам проведенных исследований было отмечено снижение эпизодов рецидивов бактериального вагиноза на 35% в сранении с плацебо (р = 0,004).
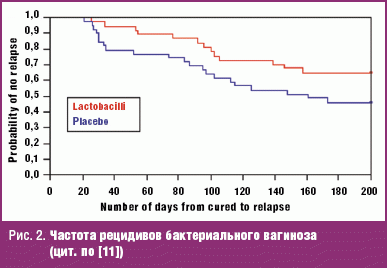
Эффект пероральной пробиотической терапии в предотвращении рецидивов бактериального вагиноза тестировался в нескольких исследованиях. Анализируя результаты сочетанной антибактериальной и пробиотической терапии, эксперты сделали два очень важных заключения: пробиотическая терапия снижает риск рецидива вагиноза, при этом наиболее эффективной следует признать терапию средствами, включавшими штаммы лактобацилл. Внимания заслуживают результаты двойного слепого рандомизированного плацебо-контролируемого исследования с включением 100 женщин с рецидивирующим течением бактериального вагиноза. Все пациентки были пролечены клиндамицином, в основной группе в качестве препарата сопровождения были перорально назначены лактобактерии, а в группе сравнения клиндамицин принимался ими в сочетании с плацебо. Частота достигнутой ремиссии при окончании антибактериальной терапии была сопоставимой в обеих группах. Вместе с тем при наблюдении пациенток на протяжении последующих трех месяцев было отмечено статистически достоверное снижение риска рецидива бактериального вагиноза (0,73(0,54–0,98),(p<0,05). Таким образом, наиболее ценным эффектом сопутствующей пробиотической терапии следует признать ее противорецидивное действие (рис. 2).
Одновременное применение пробиотиков во время лечения антибиотиками способствует нормализации микроэкологического статуса макроорганизма и повышает эффективность стандартной терапии бактериального вагиноза, прежде всего за счет снижения риска последующих рецидивов. Вместе с тем практическому врачу следует помнить, что сведения об эффективности препаратов, полученные в хорошо спланированных, адекватных исследованиях, нельзя экстраполировать в отношении всех пробиотиков, поскольку они были получены в отношении конкретного пробиотического штамма бактерий. Предпочтение следует отдавать комбинированным пробиотическим препаратам, содержащим лактобактерии наиболее эффективных штаммов. На отечественном рынке одним из таких пробиотических препаратов является Линекс, назначаемый по 2 капсулы 3 раза в день после еды на протяжении 14 дней.
М. А. Ливзан, доктор медицинских наук, профессор Е. Б. Рудакова, доктор медицинских наук, профессор ОмГМА, Омск
По вопросам литературы обращайтесь в редакцию.
