Лечащий Врач #4, 2008
Полипозный риносинусит и бронхиальная астма: взаимосвязь и лечение
Несмотря на очевидные достижения последнего десятилетия в области фармакотерапии бронхиальной астмы (БА), врачи нередко сталкиваются с пациентами, у которых казалось бы оптимальное лечение, соответствующее современным рекомендациям, не приводит к желаемым результатам: сохраняются симптомы заболевания, потребность в короткодействующих бета-агонистах (КДБА), сниженная толерантность к физической нагрузке и, как результат, — низкое качество жизни. Помимо возможных дефектов фармакотерапии одной из важных причин недостаточной эффективности лечения БА является коморбидная патология и, в частности, сопутствующие заболевания верхних дыхательных путей: аллергический ринит (АР), синусит и полипозный риносинусит (ПРС) [1, 2, 3].
Взаимосвязи АР и БА в последнее десятилетие уделяется очень большое внимание. Достаточно сказать, что экспертами ВОЗ разработана программа ARIA (Аллергический ринит и его влияние на бронхиальную астму) [1], всесторонне освещающая эту проблему, в том числе и вопросы эффективного лечения АР, сочетающегося с БА. Крупное отечественное многоцентровое эпидемиологическое исследование НАБАТ (НАциональное исследование Бронхиальной Астмы Тяжелого течения) подтвердило, что АР оказывает неблагоприятное влияние на течение в том числе и тяжелой БА [4]. Наконец, следует привести данные Crystal-Peters J. et al. [5], показавших на материале более четырех с половиной тысяч больных, что терапия АР сокращает почти в три раза частоту обострений БА.
В отличие от АР взаимоотношениям ПРС и БА уделяется гораздо меньше внимания. Вместе с тем ПРС относится к широко распространенным заболеваниям, а его частая ассоциация с БА выводит эту патологию за рамки только оториноларингологии, обусловливая междисциплинарной подход с участием ЛОР-специалистов, пульмонологов, аллергологов. Популяционные исследования, проведенные в различных странах, свидетельствуют о наличии ПРС у 1–2,7% населения, а среди обращающихся к оториноларингологам или аллергологам удельный вес пациентов с ПРС составляет 4–5% [6,7]. У больных БА частота ПРС значительно выше, чем в популяции, составляя 7–15% и, наоборот, среди пациентов с ПРС астма диагностируется в 29–70% случаев [8, 9]. Однако только частым сочетанием ПРС и БА проблема их коморбидности не исчерпывается. Хорошо известная связь между этими заболеваниями длительное время рассматривалась с позиции ринобронхиального рефлекса, что определяло целесообразность полипэктомий при БА. Современные данные, касающиеся механизмов воспаления при ПРС и, прежде всего, активной роли эозинофилов и провоспалительных цитокинов, дополнили и углубили представления о патогенезе ПРС и его взаимосвязях с БА.
Несмотря на значительное количество опубликованных материалов, вопросы этиологии ПРС во многом остаются нерешенными. Имеющиеся в настоящее время сведения о возможных причинах и патогенетических механизмах развития ПРС позволяют считать его многофакторным заболеванием. В качестве этиологически значимых факторов рассматриваются врожденные или приобретенные нарушения мукоцилиарной системы, местный иммунодефицит, инфекция, в том числе вирусная, бактериальная, грибковая. Большое число работ посвящено роли аллергии в патогенезе ПРС, и хотя не все исследователи отводят ей значимую роль, в ряде публикаций придается существенное значение аллергии в развитии данного заболевания [10, 11]. Наши исследования также подтверждают возможную роль аллергии при ПРС у значительной части больных [12]. При обследовании 112 пациентов, включающем назальные провокационные тесты с различными аэроаллергенами, аллергический характер заболевания был подтвержден в 62,4% случаев. При этом у 42,8% больных респираторная аллергия сочеталась с непереносимостью Аспирина. В целом же непереносимость ацетилсалициловой кислоты и других нестероидных противовоспалительных препаратов среди больных ПРС составила 61,6%.
Характеризуя патогенез ПРС, следует отметить, что, независимо от его этиологии, ключевое значение принадлежит эозинофильному воспалению. В рекрутировании и активировании эозинофилов основная роль отводится цитокинам (IL-5, IL-3, ФНО-a), под влиянием которых происходит активация эозинофилов в костном мозге, ингибирование их апоптоза, увеличение ими продукции провоспалительных медиаторов и, в частности, эозинофильного катионного протеина [13, 14]. Важное значение придается также дисбалансу ферментных систем, регулирующих метаболизм арахидоновой кислоты. Нарушение обмена арахидоновой кислоты сопровождается накоплением в слизистой оболочке носа лейкотриенов, простагландинов, тромбоксанов, фактора некроза опухоли (ФНО-a) и некоторых хемокинов, которые, в свою очередь, стимулируют миграцию в очаг воспаления эозинофилов, нейтрофилов, базофилов, лимфоцитов. Являясь источником провоспалительных медиаторов, обладающих выраженным токсическим действием на мерцательный эпителий, активированные клетки играют важную роль в персистировании воспалительных изменений при ПРС.
Показано, что медиаторы воспаления, продуцируемые эозинофилами и другими эффекторными клетками в полипозной ткани, могут инициировать или усиливать воспаление в нижних дыхательных путях, формируя или усиливая тем самым бронхиальную гиперреактивность. Предполагается, что своего рода «воспалительный ринобронхиальный рефлекс» может быть обусловлен либо гравитационными механизмами попадания назального содержимого в нижние отделы дыхательных путей, либо за счет системного эффекта цитокинов, способствующих вторичному рекрутированию эозинофилов и других клеток воспаления в бронхиальное дерево [2]. Приведенные данные хорошо согласуются с известными клиническими особенностями астмы, сочетающейся с ПРС: тяжелым, часто неконтролируемым течением и резистентностью к терапии [15].
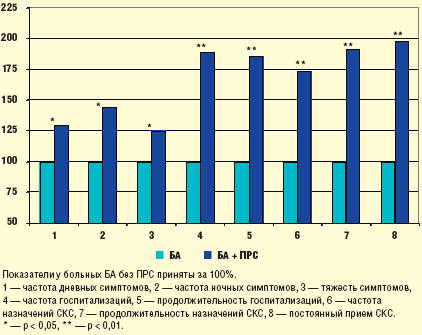
Для оценки возможного влияния ПРС на течение БА нами проведено сравнительное исследование в 2 группах больных. В 1-ю группу вошли 84 больных с тяжелым персистирующим течением БА без ПРС и во 2-ю — 47 больных, аналогичных по степени тяжести астмы, но с сопутствующим ПРС. Полученные результаты показали, что на фоне ПРС у больных достоверно чаще регистрируются симптомы БА и ее обострения, больные с ПРС чаще и на более продолжительный срок госпитализируются, им чаще назначаются системные кортикостероиды (СКС), в том числе и на постоянной основе (рис. 1). Таким образом, проведенное исследование хорошо согласуется с представлениями о том, что ПРС в значительной степени утяжеляет течение БА, увеличивает частоту и выраженность ее симптомов, способствует формированию стероидозависимого фенотипа заболевания.
Представление о ключевой роли воспаления в патогенезе ПРС явилось предпосылкой для его лечения топическими назальными кортикостероидами (НКС). Контролируемые исследования, основанные на клинико-функциональных, эндоскопических и рентгенологических методах оценки, доказали их высокую эффективность. Более того, сравнительные исследования эффективности хирургического и медикаментозного лечения ПРС показали, что во многих случаях терапия НКС может рассматриваться как альтернативный метод лечения [16, 17]. Только отсутствие эффекта от полноценной консервативной терапии должно являться показанием для оперативного лечения, которое, в свою очередь, должно дополняться НКС [6, 18].
Как показали наши наблюдения, на фоне применения Фликсоназе (флутиказон) наблюдается статистически достоверное снижение наиболее выраженных симптомов ПРС [19]. В значительной степени это касается проявлений назальной обструкции, которая после лечения регистрировались в 12 раз реже, уменьшения частоты и интенсивности патологических выделений из носа (в 9 раз), парестезий в полости носа, чихания, глазных симптомов (в 1,5–2 раза). Следует подчеркнуть, что регресс субъективной симптоматики в процессе лечения ПРС сопровождается положительной динамикой показателей назальной вентиляции. При этом наблюдалось увеличение в 1,5 раза объемного и скоростного назальных потоков и двукратное снижение носового сопротивления (р < 0,001). Многомесячное наблюдение за больными в процессе фармакотерапии ПРС показало, что эффективность лечения в значительной степени зависит от его продолжительности. Максимальное снижение симптомов заболевания и восстановление назальной вентиляции до нормальных величин по данным риноманометрии происходит у подавляющего числа больных не ранее чем через 6–9 месяцев лечения. В то же время прекращение лечения Фликсоназе у больных ПРС в группе сравнения через 3 месяца от его начала приводит к быстрому (в течение 2–3 недель) рецидиву клинико-функциональных проявлений заболевания.
Анализ эффективности лечения ПРС, рассматриваемого в качестве фактора риска неконтролируемого течения астмы, не должен ограничиваться только назальной симптоматикой, важное значение имеет оценка влияния НКС и на течение БА. Однако этому аспекту проблемы уделяется недостаточное внимание, что затрудняет выработку единых подходов к ведению больных с сочетанной патологией — БА и ПРС — врачами разных специальностей: аллергологами, пульмонологами, терапевтами и оториноларингологами. Исходя из сказанного, в нашей клинике проведено изучение влияния терапии ПРС Фликсоназе на течение БА [12]. В исследование были включены 73 больных 18–69 лет со среднетяжелым или тяжелым течением БА, сочетающейся с ПРС. Атопическая БА была у 47 больных (67,1%), интолерантность к ацетилсалициловой кислоте и/или другим нестероидным противовоспалительным препаратам отмечена у 50 пациентов (71,4%), при этом в 36 случаях (51,4%) она сочеталась с атопией. Таким образом, только у 9 (12,8%) пациентов астма и ПРС не имели аллергического характера или не сочетались с непереносимостью Аспирина и других нестероидных противовоспалительных препаратов. Несмотря на регулярное лечение различными ингаляционными кортикостероидами (ИКС) в суточной дозе 400–1200 мкг, у всех пациентов сохранялись ежедневные дневные симптомы и/или ночные — не реже 1 раза в неделю.
Обследование больных включало оценку клинического, аллергологического и функционального статуса. Анализировались частота дневных и ночных симптомов, потребность в КДБА, характер предшествующей терапии. Диагностика ПРС осуществлялась ЛОР-врачом и помимо риноскопии включала рентгенографию или компьютерную томографию придаточных пазух носа. Назальные симптомы (блокада носового дыхания, снижение обоняния, ринорея, чихание, зуд в носу) оценивались по 4-балльной шкале. Нарушения носового дыхания изучались с помощью передней активной риноманометрии, позволяющей количественно оценить назальный объемный поток (НОП) и назальное сопротивление (НС). Для определения уровня эозинофилии назального секрета анализировалась риноцитограмма.
Исследование проведено в 2 этапа (рис. 2): первый — вводный период на протяжении 3 месяцев и второй — период поддерживающей терапии длительностью 12 месяцев. Больным во вводном периоде назначались назальный КС Фликсоназе 400 мкг в сутки и ингаляционный КС Фликсотид 500 мкг в сутки в сочетании с длительно действующим b2-агонистом Cеревентом (салметерол) в суточной дозе 100 мкг. Фликсотид и Серевент назначались или раздельно, или в одном ингаляторе в виде комбинированного препарата Серетид (флутиказон/салметерол). По потребности использовались КДБА и интраназальные деконгестанты (ИнД). Во время лечения больные вели дневники для ежедневного мониторинга астматических и назальных симптомов, частоты использования КДБА и ИнД, пиковой скорости выдоха (ПСВ), измеряемой пикфлоуметром. На 2-й этап исследования не включались больные, у которых во вводном периоде имели место обострения БА или ПРС, требующие назначения системных КС.
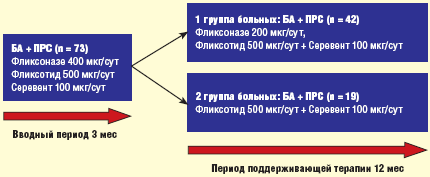
В зависимости от согласия/несогласия на 12-месячную комбинированную терапию назальными и ингаляционными КС, больные, включенные на второй этап исследования, были подразделены на 2 группы. В 1-ю вошли 42 человека, получающие лечение Фликсоназе и Фликсотидом в сочетании с Серевентом, во 2-й группе 19 больных получали только противоастматическую терапию Фликсотидом и Серевентом без НКС. Суточная доза Фликсоназе в период поддерживающей терапии была снижена до 200 мкг. Дозовый режим Фликсотида пересматривался каждые 3 месяца: при сохранении критериев контролируемой БА не менее 1 месяца перед очередным визитом, суточная доза препарата снижалась до 375–250 мкг, при отсутствии хорошего контроля — увеличивалась до 750–1000 мкг. Эффективность терапии анализировали каждые 3 месяца: учитывали динамику симптомов БА и ПРС, потребность в симптоматических средствах, показатели ПСВ, ОФВ1, НОП и НС, назальную эозинофилию. Кроме того, в качестве критерия эффективности лечения оценивались дозы Фликсотида, обеспечивающие достаточный контроль БА в сравниваемых группах.
Результаты. Проводимое 3-месячное лечение во вводном периоде сопровождалось положительной динамикой клинико-функциональных показателей как со стороны ПРС, так и БА. На фоне Фликсоназе достоверно снижалась интенсивность всех симптомов ПРС и уменьшалась потребность в ИнД более чем в 12 раз. Следует подчеркнуть высокий эффект Фликсоназе в отношении одного из наиболее тяжелых проявлений ПРС — блокады носового дыхания, степень которой снизилась в среднем в 2,2–2,5 раза. В целом же к окончанию вводного периода отмечено более чем двукратное снижение выраженности симптомов ПРС. Анализ параметров назальной вентиляции подтвердил клинический эффект Фликсоназе: по сравнению с исходными значениями НОП увеличился более чем в 1,5 раза (р < 0,001), а НС снизилось в 2 раза (p < 0,05). Помимо отмеченных клинико-функциональных эффектов лечение Фликсоназе сопровождалось снижением в назальном секрете числа эозинофилов почти в 4 раза. Уменьшение их количества в наибольшей степени происходило у пациентов с исходно высоким уровнем назальной эозинофилии. Противоастматическая терапия сопровождалась снижением частоты дневных и ночных симптомов, потребности в КДБА, увеличением показателей утренней ПСВ и ОФВ1.
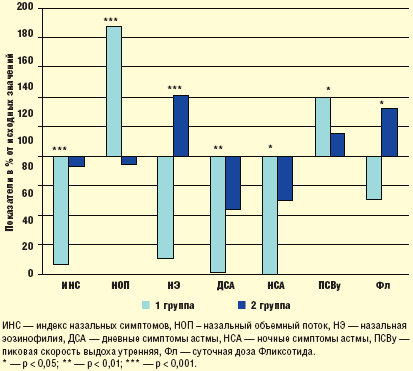
Наблюдение за больными в период 12-месячной поддерживающей терапии показало, что при исходно близких клинико-функциональных показателях в дальнейшем между сравниваемыми группами формируются отчетливые различия. Так, если в 1-й группе больных терапия Фликсоназе не только поддерживает результаты, достигнутые во вводном периоде, но и существенно их улучшает, то совершенно иная ситуация складывается у больных 2-й группы (табл. 1). У них нарастает выраженность симптомов ПРС и частота использования ИнД, снижается НОП и возрастает НС уже в течение первых 3 месяцев после прекращения приема Фликсоназе. К окончанию наблюдения перечисленные клинико-функциональные параметры существенно не отличались от таковых в период включения больных в исследование. Следует подчеркнуть, что за весь период наблюдения у больных 1-й группы по сравнению со 2-й выраженность симптомов ПРС была достоверно ниже, а показатели назальной вентиляции выше, что безусловно подтверждает эффективность Фликсоназе. На это же указывают и низкие показатели назальной эозинофилии у больных 1-й группы и четырехкратно возрастающие во 2-й группе.
Произошли ли изменения в течении БА у больных после отмены Фликсоназе? Из табл. 2 видно, что на старте поддерживающей терапии и по клиническим, и по функциональным параметрам, и по дозам Фликсотида различия между сравниваемыми группами больных отсутствовали. Однако уже через 3 месяца утренние значения ПСВ становились более низкими у больных, не получающих Фликсоназе. Через 6 месяцев различия нарастали: кроме более низкого уровня ПСВ в этой же группе больных снижался ОФВ1, чаще регистрировались дневные и ночные симптомы БА. Отмеченная закономерность — более низкий контроль БА у больных, не получающих Фликсоназе, сохранялась на протяжении всего периода поддерживающей терапии. Следует особо подчеркнуть еще одно важное обстоятельство. При сочетанной терапии Фликсоназе и Фликсотидом последний поддерживает контролируемое течение БА в значительно меньших дозах по сравнению с таковыми во 2-й группе больных. К окончанию исследования в период поддерживающей терапии доза Фликсотида у больных, получающих Фликсоназе, была снижена относительно исходных значений в среднем на 29%, тогда как в сравниваемой группе она возросла на 32%.
Итак, данная работа еще раз показала высокую эффективность Фликсоназе при ПРС, что обусловлено местным противовоспалительным действием препарата. Однако только интраназальным эффектом терапия топическими КС не ограничивается. Полученные результаты демонстрируют влияние Фликсоназе и на течение БА, сочетанной с ПРС (рис. 3). Помимо локального действия — восстановления носового дыхания и снижения назальной эозинофилии — терапия НКС увеличивает эффект противоастматического лечения, оказывая своего рода аддитивное действие: у больных, получающих Фликсоназе, достоверно ниже частота симптомов БА и выше показатели бронхиальной проходимости. При этом лучший контроль БА обеспечивают меньшие дозы Фликсотида.
Каковы же механизмы «противоастматического» эффекта Фликсоназе? Исходя из данных о патогенетическом влиянии заболеваний верхних дыхательных путей на БА, наиболее вероятным представляется подавление «воспалительного» ринобронхиального рефлекса. Уменьшая воспаление в слизистой оболочке носа, придаточных пазух и полипозной ткани, НКС ингибируют продукцию ряда провоспалительных медиаторов, поддерживающих воспаление не только верхних, но и нижних дыхательных путей [2, 8]. Косвенным подтверждением этих представлений является снижение уровня назальной эозинофилии в наших наблюдениях у больных, получающих Фликсоназе.
Таким образом, рассматривая подходы к лечению коморбидных заболеваний респираторного тракта — ПРС и БА — можно сделать вывод о том, что длительное применение НКС и Фликсоназе, в частности, оптимизирует лечение астмы и способствует достижению ее контролируемого течения. Неадекватная терапия ПРС, а тем более ее отсутствие, напротив, приводит к обострению и более тяжелому течению БА.
Литература
-
ARIA. Аллергический ринит и его влияние на бронхиальную астму // Аллергология. 2001 (Приложение). № 3. С. 43–56.
-
The Nose and Lung Diseases / Ed. By B. Wallaert, P. Chanez, P. Godard. Eur. Resp. Monograph. 2001. 183 p.
-
Larsen K. The clinical relationship of nasal polyps to asthma // Allergy Asthma Proc. 1996. Vol. 17. Р. 243–249.
-
Чучалин А. Г., Огородова Л. М., Петровский И. Ф. и др. Мониторирование и лечение тяжелой бронхиальной астмы у взрослых: результаты Национального многоцентрового исследования НАБАТ // Терапевтический архив. 2005. № 3. С. 36–43.
-
Crystal-Peters J., Neslusan C., Crown W. H. Treating allergic rhinitis in patients with comorbid asthma: the risk of asthma-related hospitalizations and emergency department visits // J. Allergy Clin Immunol. 2002. № 1. P. 57–62.
-
Лопатин А. С. Медикаментозное лечение полипозного риносинусита // Consilium medicum. 2002. № 9. С. 461–468.
-
Slavin R. G. Nasal polyps and sinusitis // JAMA. 1997. № 22. P. 1849–1854.
-
Samolinski B., Szczesnowicz-Dabrowska P. Relationship between inflammation of upper and lower respiratory airways // Otolaryngol. Pol. 2002. Vol. 56. Р. 49–55.
-
Grigoreas C., Vourdas D., Petalas K. et al. Nasal polyps in patients with rhinitis and asthma // Allergy Asthma Proc. 2002. Vol. 23. P. 169–174.
-
Suzuki M., Watanabe T., Suko T. Comparison of sinusitis with and without al lergic rhinitis: characteristics of paranasal sinus effusion and mucosa // Am J. Otolaryngol. 1999. № 3.
P. 143–150. -
Togias A. Rhinitis and asthma: evidence for respiratory system integration // J. Allergy Clin Immunol. 2003. № 6. P. 1171–1183.
-
Черняк Б. А., Секретарева Л. Б., Воржева И. И. Оптимизация терапии бронхиальной астмы, сочетающейся с полипозным риносинуситом // Российский аллергологический журнал. 2004. № 4. С. 17–23.
-
Rudack C., Stoll W., Bachert C. Cytokines in nasal polyposis, acute and chronic sinusitis // Am J. Rhinol. 1998. № 12. P. 383–388.
-
Singh H., Ballow M. Role of cytokines in nasal polyposis // J. Investig Allergol Clin Immunol. 2003. № 1. P. 6–11.
-
Magnan A., Romanet S., Vervloet D. Rhinitis, nasosinusal poliposis and asthma: clinical aspects // The Nose and Lung Diseases / Ed. By B.Wallaert, P. Chanez, P. Godard. Eur. Resp. Monograph. 2001. P. 101–115.
-
Filiaci F., Passali D., Puxeddu R. A randomized controlled trial showing efficacy of once dally intranasal budesonide in nasal polyposis // Rhinology. 2000. Vol. 38. P. 185–190.
-
Blomqvist E. H., Lundbland L., Anngard A. et al. A randomized controlled study evaluating medical treatment versus surgical treatment in addition to medical treatment of nasal poliposis // J. All. Clin. Immunol. 2001. Vol. 107. P. 224–228.
-
European Position Papper on Rhinosinusitis and Nasal Poliposis. Rhinology, Supplement 20, 2007.
-
Черняк Б. А., Носуля Е. В., Секретарева Л. Б., Ким Е. А. Влияние продолжительности терапии назальными КС на ее эффективность при полипозном риносинусите // Пульмонология. 2005. № 2. С. 107–112.
Б. А. Черняк, доктор медицинских наук, профессор
И. И. Воржева, кандидат медицинских наук, доцент
ИГИУВ, Иркутск
