Лечащий Врач #3, 2008
Редкие формы ожирения
Известно, что ожирение является заболеванием с наследственной предрасположенностью. И хотя вероятность развития ожирения и степень его проявления во многом зависят от образа жизни и характера питания, в исследованиях, проведенных на близнецах, было показано, что генетические факторы играют важную роль в этиологии ожирения [2]. Всего в публикациях последних лет описано более 430 генов, маркеров и хромосомных участков, связанных с ожирением у людей [41].
Среди редких форм ожирения можно выделить две группы — синдромы, сочетающиеся с развитием ожирения, и моногенные формы ожирения.
К синдромальным формам относят ожирение, наблюдаемое при остеодистрофии Олбрайта, синдроме Прадера–Вилли, Дауна, Кохена, Лоуренса–Муна–Барде–Бидля и др. (табл. 1). Эти формы ожирения отличаются широким клиническим полиморфизмом. Особенностями синдромальных форм ожирения являются разный возраст дебюта ожирения — от первых месяцев жизни до периода позднего детства, разная степень его выраженности — от умеренного до морбидного, наличие специфических фенотипических черт. Как правило, все эти пациенты имеют неврологические нарушения, выраженную задержку психомоторного развития и сниженный интеллект.
Несмотря на то, что для большинства синдромов определены генетические дефекты и маркеры, их функция остается неизвестной. Поэтому патогенез и причины развития ожирения синдромальных форм также не установлены.
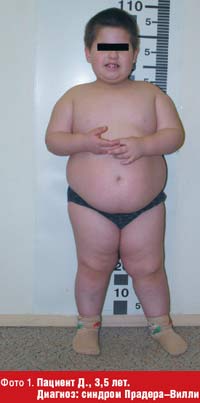 Для синдрома Прадера–Вилли (фото 1) характерна выраженная мышечная гипотония, наблюдаемая при рождении и сохраняющаяся в течение первого года жизни ребенка, задержка психомоторного развития, гипогонадотропный гипогонадизм, крипторхизм, сниженный интеллект, низкий рост, нарушение сна и терморегуляции [5, 19]. Фенотипические особенности включают: относительно небольшие размеры кистей и стоп (акромикрия), долихоцефалию, миндалевидный разрез глаз, низкорасположенные ушные раковины, широкую переносицу, маленький рот с тонкой верхней губой.
Для синдрома Прадера–Вилли (фото 1) характерна выраженная мышечная гипотония, наблюдаемая при рождении и сохраняющаяся в течение первого года жизни ребенка, задержка психомоторного развития, гипогонадотропный гипогонадизм, крипторхизм, сниженный интеллект, низкий рост, нарушение сна и терморегуляции [5, 19]. Фенотипические особенности включают: относительно небольшие размеры кистей и стоп (акромикрия), долихоцефалию, миндалевидный разрез глаз, низкорасположенные ушные раковины, широкую переносицу, маленький рот с тонкой верхней губой.
Частота встречаемости данного синдрома не известна, но, согласно данным Международного общества пациентов с синдромом Прадера–Вилли (www.ipwso.org ), в мире насчитывается свыше 5000 случаев. Хромосомные аномалии при синдроме Прадера–Вилли включают делецию участка или дисомию 15 хромосомы (15 q11–q12) и выявляются у 70% этих пациентов [28].
Дети рождаются с нормальными росто-весовыми показателями, имеют умеренный набор веса в течение первого года жизни с последующим быстрым развитием морбидного ожирения нередко к второму-третьему году жизни, на фоне выраженной полифагии [19]. Развитие ожирения при синдроме Прадера–Вилли связывали со сниженным уровнем метаболизма у этих пациентов [4]. Однако Schoeller D. с соавт. показали, что низкая скорость основного обмена у этих детей связана первично с избытком массы свободного жира, а не генетически обусловленным низким уровнем метаболизма [39].
Недавно было показано, что больные с синдромом Прадера–Вилли, в отличие от пациентов с простым (конституционально-экзогенным) ожирением, имеют высокие уровни грелина [7]. Грелин — орексигенный гормон, секретирующийся в желудке и обладающий широким спектром действия: стимулирует секрецию гормона роста, пролактина и адренокортикотропного гормона (АКТГ); влияет на сон и поведение, повышает аппетит, увеличивает уровень глюкозы в крови [25]. Грелин активирует нейроны гипоталамуса и аркуатных ядер, что приводит к положительному энергетическому балансу благодаря стимуляции потребления пищи и снижению утилизации жира [23]. У здорового человека уровень грелина повышается перед едой и снижается постпрандиально [6, 46]. Возможно, гипергрелинемия приводит к развитию полифагии у больных с синдромом Прадера–Вилли. Причины высокого уровня грелина при синдроме Прадера–Вилли остаются неизвестными. Участок хромосомы 15q11–13, ответственный за этот синдром, не объясняет данной симптоматики, поскольку ни грелин, ни его рецептор не относятся к этому участку. Возможно, дальнейшее изучение этого феномена поможет объяснить патогенез ожирения при данном синдроме.
Пациенты с синдромом Лоуренса–Муна–Барде–Бидля часто при рождении имеют добавочные пальцы кистей и стоп (полидактилия), мышечную гипотонию. Ожирение развивается со второго года жизни ребенка, характерен гипогонадизм. Из других аномалий развития часто встречается поликистоз почек, пигментный ретинит. Интеллект снижен. Предполагается, что прогрессивный набор веса у этих детей обусловлен дисфункцией центра насыщения в гипоталамусе, что приводит к полифагии [3].
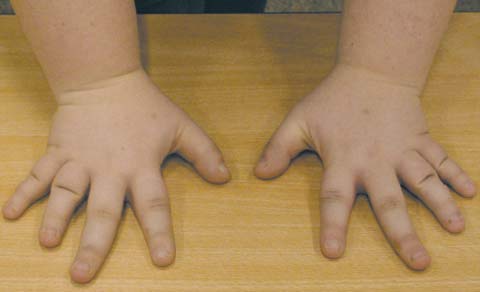
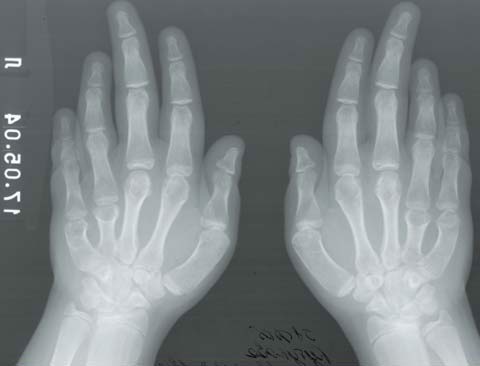
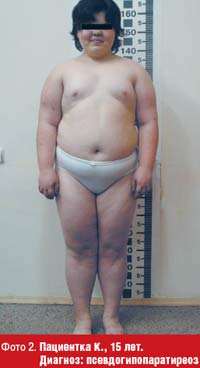 Для псевдогипопаратиреоза (фото 2) характерно ожирение в сочетании с низким ростом, брахидактилией (двустороннее укорочение 4-й и 5-й пястных и плюсневых костей (фото 3, 4), короткой шеей, лунообразным лицом, множественными подкожными оссификатами, гипокальциемией и повышенным уровнем парат-гормона [36, 42]. Характерны гипотиреоз и гипогонадизм, реже — сахарный диабет. Интеллект снижен. На сегодняшний день выделяют несколько типов псевдогипопаратиреоза, большинство случаев является семейными формами, при всех типах наблюдается резистентность тканей-мишеней к парат-гормону. Лучше всего изучен патогенез псевдогипопаратиреоза типа 1 А, обусловленный мутацией гена, кодирующего a-субъединицу G-белка (GNAS1), в результате которой дефектные G-белки не активируют аденилатциклазу, либо их активность снижена.
Для псевдогипопаратиреоза (фото 2) характерно ожирение в сочетании с низким ростом, брахидактилией (двустороннее укорочение 4-й и 5-й пястных и плюсневых костей (фото 3, 4), короткой шеей, лунообразным лицом, множественными подкожными оссификатами, гипокальциемией и повышенным уровнем парат-гормона [36, 42]. Характерны гипотиреоз и гипогонадизм, реже — сахарный диабет. Интеллект снижен. На сегодняшний день выделяют несколько типов псевдогипопаратиреоза, большинство случаев является семейными формами, при всех типах наблюдается резистентность тканей-мишеней к парат-гормону. Лучше всего изучен патогенез псевдогипопаратиреоза типа 1 А, обусловленный мутацией гена, кодирующего a-субъединицу G-белка (GNAS1), в результате которой дефектные G-белки не активируют аденилатциклазу, либо их активность снижена.
Наиболее ярким примером роли генетики в контроле веса и энергетического гомеостаза являются мутации в одиночных генах, приводящие к развитию стойкого морбидного ожирения. Это так называемые моногенные формы ожирения [24, 29].
Для обеспечения энергетического равновесия потребление энергии должно быть равно ее затратам. Пищевое поведение контролируется гипоталамусом через множество различных сигнальных молекул и рецепторных систем. Выделены две группы пептидов — стимулирующие (орексигенные) и подавляющие (анорексигенные) аппетит (табл. 2).
В последние годы анатомические взаимоотношения различных центров головного мозга и синтезируемых ими нейропептидов изучены более подробно [40]. Показано, что при взаимодействии лептина с клетками дугообразного ядра гипоталамуса активируется две группы нейронов: содержащие нейропептид Y и/или эндогенный ингибитор меланокортинового механизма агути-связанный пептид (АГСП) и содержащие проопиомеланокортин (РОМС). Эти клетки передают возбуждение в паравентрикулярное ядро и латеральную область гипоталамуса, где их аксоны взаимодействуют с другими эффекторными клетками, содержащими орексины. Изменение уровня лептина стимулирует или подавляет активность этих центров головного мозга и таким образом увеличивает или уменьшает потребление пищи [1].
Лептин был первым из открытых гормонов, специфично участвующих в регуляции массы тела у человека. Из известных на сегодняшний день моногенных форм ожирения большинство связано с нарушениями лептин-меланокортинового пути регуляции массы тела [11, 14, 27, 33].
Меланокортины — группа гормонов, в которую входит белок агути (название «агути» дано по цвету шерсти, например, мыши), меланоцитстимулирующий гормон (МСГ) и АГСП. Лучше других изучен a-МСГ; это фрагмент более крупной молекулы РОМС, вырабатываемого в передней доле гипофиза. Из РОМС образуется также АКТГ. АКТГ регулирует функцию надпочечников, а МСГ — несколько процессов, в том числе пигментацию кожи. МСГ действует через рецепторы меланокортинов, из которых МС3R и МС4R регулируют массу тела. Значение МС4R для регуляции массы тела было показано в исследованиях на трансгенных мышах, у которых этот рецептор не синтезируется. У них развивается ожирение с инсулинорезистентностью. МСГ и другие лиганды, стимулируя МС4R, подавляют потребление пищи. Значение эндогенного α-МСГ для регуляции массы тела показано на мышах с мутацией гена, обеспечивающего синтез POMC. Это сопровождается отсутствием α-МСГ, перееданием, ожирением. Таким образом, можно предположить, что эндогенный α-МСГ является агонистом МС4R и нарушение его синтеза сопровождается ожирением. Рецепторы МСГ выявлены в коре надпочечников; через них реализуется действие АКТГ.
Соответственно, мутации генов, нарушающие синтез любого из компонентов лептин-меланокортинового пути, могут приводить к развитию стойкого морбидного ожирения на фоне полифагии. У человека описаны мутации генов лептина (LEP, 7q31.3), рецептора лептина (LEPR, 1p31–p32), проопиомеланокортина (РОМС, 2p23.3), рецепторов меланокортинов 3-го и 4-го (МС3R и МС4R, 18q22). Морбидное ожирение, прогрессирующее с раннего детства, — наиболее общий признак всех моногенных форм, подтверждающий центральную роль этих генов в регуляции массы тела.
В 1997 г. Montague C. с соавт. описали двух детей с выраженным ожирением и неопределяемым уровнем лептина в сыворотке крови. Дети были от близкородственного брака, из Пакистана, и имели гомозиготную мутацию (ΔG133) гена лептина (LEP), которая нарушала синтез белка [34]. На сегодняшний день опубликованы данные о 12 пациентах с врожденным дефицитом лептина вследствие мутации гена LEP, из них 3 пациента — взрослые [18, 34, 48].
Дети с врожденным дефицитом лептина имеют нормальный вес при рождении, но уже в течение первых месяцев жизни у них отмечается повышенный аппетит, что приводит к катастрофически быстрому набору избыточной массы. Для них характерна полифагия с проявлением агрессии при попытке ограничения питания и ранняя выраженная гиперинсулинемия, сопровождающаяся развитием сахарного диабета 2 типа нередко на 3–4-й декаде жизни [12]. Клинически ожирение равномерное, с преимущественным развитием подкожно-жировой клетчатки, умственное развитие детей не нарушено. Врожденный дефицит лептина сочетается с гипогонадотропным гипогонадизмом и вторичным гипотиреозом, требующим у части пациентов заместительной терапии левотироксином. Экспериментальные исследования предполагают важную роль лептина в синтезе и секреции тиреотропного гормона [16, 17].
Дети с дефицитом лептина имеют нормальные показатели линейного роста и уровня инсулиноподобного фактора роста 1 (ИФР-1). Однако наличие гипогонадотропного гипогонадизма сопровождается отсутствием пубертатного ускорения роста, поэтому конечный рост этих пациентов ниже популяционного [12]. Еще одной особенностью врожденного дефицита лептина является наличие выраженного Т-клеточного иммунодефицита, что клинически проявляется частыми инфекционными заболеваниями с высоким риском смертности [38].
Уникальность данного генетического дефекта — возможность эффективного лечения: подкожное введение рекомбинантного человеческого лептина приводит к выраженному уменьшению полифагии уже на 3-й день лечения, нормализует исходно низкий уровень основного обмена и в конечном итоге наблюдается стойкое снижение веса с достоверным уменьшением массы свободного жира [9, 12, 30]. Через 1 месяц лечения исследователи отмечали нормализацию тиреоидных гормонов с полной отменой заместительной терапии. Кроме того, лечение рекомбинантным лептином сопровождалось самостоятельной индукцией пубертатного развития как у взрослых, так и у подростков и не вызывало преждевременного полового развития у детей допубертатного возраста [9].
Гетерозиготные носители мутаций гена LEP имеют низкий уровень лептина в сочетании с ожирением [10].
В 1998 г. Сlement K. с соавт. описали случай трех сестер из Алжира с морбидным ожирением, обусловленным мутацией гена рецептора лептина (LEPR). Данная мутация вызывает нарушение сплайсинга с укорочением рецептора. У всех сестер определялся высокий уровень лептина в сыворотке крови — 600, 670 и 526 нг/мл (14). В 2007 г. Farooqi S. с соавт. опубликовали данные еще о 8 пациентах (из Англии (2), Турции (2), Бангладеш (1), Ирана (1), Норвегии (1), Европы (1)) с доказанной мутацией гена LEPR [15]. Все описанные мутации связаны с нарушением рецепторного сигналинга. Клиническая картина врожденного дефицита рецептора лептина во многом подобна наблюдаемой у пациентов с дефицитом лептина: характерна гиперфагия с развитием морбидного ожирения в течение первых лет жизни, гипогонадотропный гипогонадизм, частые инфекции, низкий конечный рост. При этом у пациентов с мутацией гена LEPR уровень инсулина может быть нормальным, сахарный диабет выявлен только у двух взрослых больных в возрасте 41 и 55 лет. Ни у одного из пациентов не отмечено снижения уровня тиреоидных гормонов [15]. Трое из взрослых женщин (31, 41, 55 лет) имели нерегулярный менструальный цикл без выраженного развития вторичных половых признаков. Все пациенты имели нормальное умственное развитие.
Самый удивительный и значимый вывод данного исследования — уровень лептина у всех пациентов был различным (от 14 до 365 нг/мл) и не отличался от такового у пациентов с морбидным ожирением без мутации гена LEPR, т. е. «чрезмерно высокий» уровень лептина не может служить маркером мутаций гена LEPR.
Гетерозиготные носители мутаций гена LEPR чаще имеют ожирение, при этом уровень лептина у них коррелирует с индексом массы тела [15].
Сочетание быстропрогрессирующего морбидного ожирения, повышенного аппетита и надпочечниковой недостаточности с неопределяемыми в сыворотке крови уровнями кортизола и АКТГ характерны для врожденного дефицита РОМС. В 1998 и 2003 гг. Krude Н. с соавт. описали случаи пяти пациентов с гомозиготной и сочетанной гетерозиготной мутациями гена РОМС, у которых наряду с ожирением, гипокортицизмом отмечались рыжие волосы и очень бледная кожа [26, 27]. В 2006 г. Farooqi S. с соавт. выявили подобные мутации гена РОМС еще у шести больных [14]. Все дети с выявленными мутациями гена РОМС характеризуются ранним развитием клинически выраженной надпочечниковой недостаточности (вторичной, связанной с дефицитом АКТГ, предшественником которого является РОМС) с характерной гипогликемией, длительной желтухой, предрасположенностью к тяжелым инфекциям, что в одном случае привело к смерти новорожденного [14]. Все симптомы купируются при назначении заместительной глюкокортикоидной терапии, при этом с первых месяцев жизни (в одном случае — до назначения заместительной терапии) развивается выраженное ожирение с полифагией.
Наличие рыжих волос и бледной кожи, наблюдаемое у большинства пациентов, считалось достоверным признаком дефицита РОМС, который является предшественником МСГ, важного для образования эумеланина меланоцитами кожи. Однако в 2006 г. у темноволосого пациента из Турции был выявлен и доказан дефицит РОМС [8]. Возможно, это связано с этническими особенностями — все пациенты с рыжим цветом волос и дефицитом РОМС были европеоидами. С другой стороны, можно предположить, что синтез эумиелина определяется не только влиянием меланокортинов. Попытка лечения пациентов с дефицитом РОМС путем интраназального введения синтетического аналога меланокортина, обладающего анорексигенным эффектом, была безуспешной: на фоне терапии в течение трех месяцев не отмечалось значимого снижения веса [27].
Другим примером моногенного ожирения является дефицит конвертазы 1-го типа — фермента, превращающего неактивные молекулы проинсулина, проопиомеланокортина и проглюкагона в их активные формы. Общими клиническими симптомами данной формы, выявленной у трех пациентов в мире, являются раннее выраженное ожирение, гипогонадотропный гипогонадизм, постпрандиальная гипогликемия, низкий уровень кортизола сыворотки крови в сочетании с синдромом мальабсорбции [21, 22, 37].
Из известных гетерозиготных мутаций, достоверно связанных с развитием ожирения, наиболее распространенными являются мутации гена рецептора меланокортинов 4-го типа (МС4R), выявляемые у 4% (0,5–6%) людей с ранним дебютом ожирения в анамнезе [11, 13, 20, 33, 45, 44, 47]. Для этой формы характерно сочетание полифагии, ранней гиперинсулинемии, равномерного быстрого увеличения массы как жировой, так и мышечной и костной ткани, что в сочетании с высоким линейным ростом приводит к формированию фенотипа «человек-гора» [14]. При этом отсутствует нарушение функции щитовидной железы, надпочечников; все пациенты имеют нормальное половое развитие, фертильность сохранена. Уровень лептина коррелируется с индексом массы тела [13, 20, 44, 47]. Специфическая терапия данной формы на сегодняшний день отсутствует.
Наиболее тяжелым и наименее изученным на сегодняшний день является гипоталамическое ожирение — яркий пример приобретенных нарушений, вызванных негенетическими причинами. Под термином «гипоталамическое ожирение» понимают ожирение, связанное с лечением опухолей гипоталамуса и ствола мозга, лучевой терапией опухолей головного мозга и гемобластозов, травмой черепа или инсультом [35].
Гипоталамическое ожирение является серьезным осложнением, которое наблюдается у 50% детей, перенесших оперативное или лучевое лечение по поводу опухолей гипоталамуса и ствола мозга, а также травму черепа. При данной форме ожирения какие-либо диетические или фармакологические воздействия неэффективны, что часто приводит к такой сопутствующей патологии, как гипертензия, обструктивное апное во сне, дислипидемия и психосоциальная дисфункция. Считается, что в патогенезе данной формы ожирения, подтверждаемом исследованиями на моделях животных, принимает участие повреждение вентромедиального гипоталамуса. В результате усиливается стимулирующее влияние вагусного нерва на b-клетки поджелудочной железы, усиление секреции инсулина в ответ на глюкозу с последующим накоплением энергии в виде жира и, в конечном счете, развитием ожирения [31, 32]. Попытки ограничения потребления калорийной пищи или фармакотерапии адренергическими или серотонинергическими препаратами приводили к небольшому или кратковременному эффекту при лечении этого синдрома. Сочетанные заболевания, связанные с этой вегетативной дисфункцией, в настоящее время не известны. Продолжительность жизни пациентов с гипоталамическим ожирением короче, в основном вследствие стойкого ожирения.
Учитывая вышесказанное, очевидно, что ожирение является полигенным заболеванием. Открытие в современной науке моногенных форм ожирения позволяет лучше понять сложные механизмы контроля пищевого поведения, энергетического гомеостаза.
По вопросам литературы обращайтесь в редакцию.
В. А. Петеркова, доктор медицинских наук, профессор
О. В. Васюкова, кандидат медицинских наук
ЭНЦ Росмедтехнологий, Москва
Компания UСB — лауреат Национальной премии в области бизнеса 2007 года в специальной номинации «Реализация инновационных проектов в биофармацевтике»
В декабре 2007 года в Москве в Президент-Отеле состоялась торжественная церемония награждения лауреатов Национальной премии «Компания года». По результатам экспертных оценок, заключению Почетного жюри и решению Оргкомитета премии компания UCB (ЮСБ) заслужила звание лауреата Национальной премии в области бизнеса 2007 года в специальной номинации «Реализация инновационных проектов в биофармацевтике».
По итогам событий 2007 года состоялась пресс-конференция Московского представительства компании UCB.
Появление новейших эффективных лекарственных средств предоставляет врачам новые возможности для успешного лечения тяжелейших болезней. Компания UCB — мировой лидер в области биофармацевтики, специализируется на четырех терапевтических направлениях — заболевания центральной нервной системы (включая эпилепсию), респираторные заболевания и аллергия, воспалительные процессы и иммунология, онкология. Основная задача UCB — укрепление здоровья и улучшение качества жизни пациентов, поэтому компания концентрирует свою деятельность на разработке инновационных препаратов. В 2008 году UCB выводит на рынок новейший препарат, ставший результатом инновационных разработок последних лет. Ньюпра — препарат ориентирован на лечение болезни Паркинсона и представляет собой трансдермальный пластырь. Это уникальная форма доставки лечащего вещества, действующая 24 часа.
Впервые компания вышла на российский рынок в 1994 году, но уже за этот период времени ряд основных продуктов компании получил широкое распространение и признание в России. Среди них:
Кеппра — лидер в лечении эпилепсии, считающийся в США лекарством № 1.
Ксизал — антигистаминный препарат последнего поколения. Обычно такой препарат, попадая в организм, распадается на молекулы, многие из которых не активны, и только одна взаимодействует с гистаминным рецептором, предотвращая аллергическую реакцию. Ксизал является энантиомером — молекулой, которая активна и больше не расщепляется. Отличие состоит в том, что вместо «пустых» неактивных молекул организм получает все рабочие. Ксизал максимально блокирует медиаторы аллергического воспаления, к тому же практически безопасен для печени.
Зиртек — применяется для симптоматического лечения круглогодичного и сезонного аллергического ринита и аллергического конъюнктивита и одобрен к применению в более чем 100 странах для лечения взрослых и детей.
Сейчас в стадии разработки находятся 10 молекул, которые будут применены при 17 заболеваниях. В данный момент проходит 1-я стадия клинических испытаний препаратов для лечения онкологии (рак легкого), рассеянного склероза.
Существует Институт аллергии UCB, основной целью деятельности которого является совершенствование профилактики и лечения аллергии с помощью обеспечения врачей и населения современной научной информацией и внедрения образовательных программ по аллергологии. Разработаны обучающие программы для семейных врачей и врачей общей практики, в которых представлены основные сведения об иммунных механизмах аллергии, даны описания историй болезни с клиническим разбором и алгоритмы диагностики. Институт уникален тем, что занимается проведением обучающих программ среди врачей и пациентов без упоминания о препаратах, выпускаемых компанией UCB.
