Ожирение и артериальная гипертония
Сегодня в мире наблюдается настоящая эпидемия — 30% населения Земли страдают ожирением, не включая тех, кто имеет просто избыток массы тела. Ожирение это не только избыточный объем жировой ткани, обладающий тенденцией к прогрессированию в отсутствие специфической терапии, но и сложный комплекс метаболических нарушений.
Большинство обеспеченных людей, особенно в крупных городах цивилизованных стран, стремятся соответствовать современным стереотипам человеческой красоты и используют все доступные методы сохранения и поддержания «вечной молодости». Особенно это актуально среди населения репродуктивного возраста, когда нет еще серьезных хронических заболеваний и вопросы здоровья, как такового, их мало беспокоят, но есть желание достойно выглядеть, чтобы найти престижную работу, приобрести спутника жизни, обзавестись семьей, словом, быть в социуме. Когда к 50–60 годам жизни, а порой и ранее, возникают серьезные проблемы со здоровьем (артериальная гипертония (АГ), ишемическая болезнь сердца (ИБС), сахарный диабет (СД), заболевания суставов, гормональные нарушения и др.), то сопутствующее ожирение, если оно имеет место, уходит на второстепенный план. Тогда все внимание в лечении направлено на устранение возникших недугов, упуская из вида, что их причиной, возможно, является именно избыточное отложение жировой ткани.
Ожирение часто сочетается с такими заболеваниями, как ИБС, АГ, инфаркты, инсульты, дислипидемия, СД 2 типа, подагра, бесплодие, поликистоз яичников, «венозный тромбоэмболизм», «ночное апное» и др. [7, 8, 15]. Представление о связи избытка жировой ткани с сердечно-сосудистыми заболеваниями (ССЗ) было сформировано еще более 50 лет назад. Известный клиницист Е.М.Тареев в 1948 г. писал: «Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза — холестерином, мочевой кислотой…» [4, 7].
Жировая ткань — не просто пассивный накопитель жира — «аккумулятор энергии», но одновременно она является активным эндокринным органом, способным синтезировать и секретировать в кровоток различные биологически активные соединения пептидной и непептидной природы, играющие важную роль в гомеокинезе различных систем, в том числе и сердечно-сосудистой системы. Адипоциты — функциональные единицы жировой ткани являются источником фактора некроза опухолей-альфа (ФНО-α), ингибитора активатора плазминогена-1 (ИАП-1), интерлейкина-6 (ИЛ-6), лептина, ангиотензиногена, инсулиноподобного фактора роста-1 (ИФР-1) [3, 7, 12].
У мужчин и женщин повышение массы тела часто сопровождается повышением артериального давления, сопряженного с активацией симпатического тонуса, вызванного развитием инсулинорезистентности (ИР), нарушением уровней липидов плазмы в сторону атерогенной дислипидемии. Эти изменения имеют тенденцию к прогрессированию при дефиците эстрогенов, гормонов щитовидной железы. Таким образом, ожирение — один из факторов в созвездии метаболических нарушений, которые приводят к развитию артериальной гипертонии [4, 9, 11].
Увеличение массы тела (МТ) за счет высокой пропорции висцеральной жировой ткани в значительной степени связано с развитием АГ и целого ряда других метаболических факторов риска ССЗ. Зависимость между ожирением и АГ была документально подтверждена в Фрамингемском исследовании (Framingham Heart Study), которое показало, что по мере увеличения МТ относительно роста значительно увеличивается распространенность АГ в различных возрастных группах населения у лиц обоего пола. Отмечено, что одним из важных факторов развития АГ является недавняя прибавка массы тела; по данным Фрамингемского исследования, около 70% случаев впервые выявленная АГ ассоциировалась с недавней прибавкой веса или ожирением [4, 7, 9].
Частота и тяжесть сопряженных с ожирением нарушений и заболеваний зависят не только от степени ожирения, но и от особенностей локализации отложения жировой ткани в организме. Еще в 1947 году J. Vague описал два типа отложения жира — андроидный (мужской — «яблоковидный») и гиноидный (женский, глютеофеморальный — «грушевидный»), обратив внимание на то, что андроидное ожирение чаще сочетается с СД, ИБС, подагрой. Еще одним значимым фактором развития АГ, помимо повышения массы тела, является абдоминальное распределение жировой ткани. Косвенными маркерами распределения жировой ткани по андроидному (мужскому, яблоковидному) типу является увеличение окружности живота, а также увеличение отношения окружности талии (ОТ) к окружности бедер (ОБ) — ОТ/ОБ > 0,9. Жировая ткань у мужчин (висцеральное ожирение) — «ловушка андрогенов», и чем более выражено абдоминальное ожирение, тем больше гормонов поглощается жировой тканью. Кроме того, эти признаки представляют собой значимый независимый фактор повышения артериального давления, а также независимо сочетаются с другими факторами риска ССЗ.
Связь между ожирением и артериальным давлением не может быть адекватно объяснена только гемодинамическими изменениями в организме, поскольку в таком случае у больных с ожирением был бы повышен объем циркулирующей крови (ОЦК) и индекс сердечного выброса (ИСВ), в то время как они остаются в пределах нормы после поправки на массу тела. Недостаточным является и такое объяснение, как повышенное потребление натрия больными с избыточной массой тела, поскольку снижение массы тела у лиц с ожирением сопровождается независимым уменьшением артериального давления даже в тех случаях, когда уровни потребления натрия остаются прежними. Таким образом, сдвиг кривой давление–натрий у лиц с избыточной массой тела, вероятно, является вторичным и обусловлен симпатической гиперактивностью и активацией ренин-ангиотензин-альдостероновой системы (РААС), ИР и гиперинсулинемией — т. е. факторами, которые взаимосвязаны между собой.
Эксперты ВОЗ, на основе величины Индекс Массы Тела (ИМТ — индекс Кетле), который определяется как отношение массы (W [кг]) к поверхности тела (S [м2]) – ИМТ = W/S [кг/м2], предложили классификацию критериев ожирения, как факторов риска ССЗ (табл. 1) [4, 7, 9].
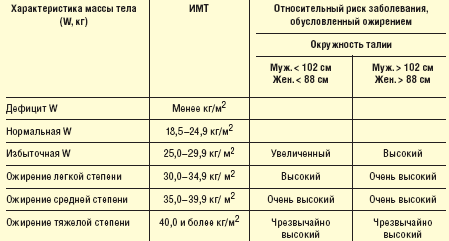
Ранее ожирение диагностировалось при значении ИМТ, превышающим 30 кг/м2. В настоящее время установлено, что показатель сердечно-сосудистого риска начинает возрастать при более низких значениях ИМТ (25 кг/м2). В соответствии с этим значение ИМТ в диапазоне 25,0–29,9 кг/м2 было предложено рассматривать как «избыточную массу тела».
В настоящее время изучение нейробиологии ожирения показало — у лиц, страдающих ожирением, активность симпатической нервной системы в кровеносных сосудах почек и скелетной мускулатуры увеличена, что подтверждает нейрогенный характер АГ при ожирении. Активация симпатоадреналовой системы при избыточной массе тела в основном является следствием ИР, в результате уменьшения плотности инсулиновых рецепторов на увеличенных в размерах и количественно адипоцитах. Повышение тонуса симпатоадреналовой системы сопровождается активацией РААС, что суммарно ведет к повышению артериального давления (АД) (рис. 1). ИР характеризуется отсутствием ночного снижения АД (Non-Dipper), что также клинически подтверждает патологическое повышение симпатического тонуса при висцеральном ожирении.
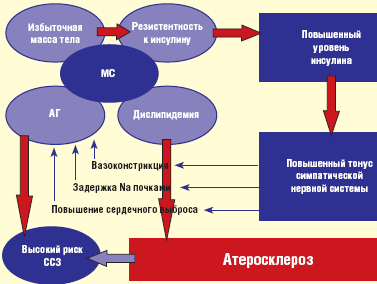
В 1989 г. J. Kaplan уделил особое внимание абдоминальному (висцеральному) ожирению с гипертриглицеридемией, с нарушением толерантности к глюкозе (НТГ), АГ, и описал этот симптомокомплекс как «смертельный квартет». Абдоминальное ожирение часто сочетается с ИР, НТГ, гиперинсулинемией, дислипидемией, ранним атеросклерозом (рис. 1), недостаточным снижением уровня АД в ночное время, АГ, ИБС, микроальбуминурией, нарушениями гемостаза, нарушениями пуринового обмена, синдромом ночного апноэ, стеатозом печени и поликистозом яичников, которые суммарно определяют понятие «метаболического синдрома» (МС) — термин, предложенный G. M. Reaven в 1996 г. [4, 9].
К сожалению, на практике диагностика сочетаний этих метаболических нарушений часто происходит случайно.
Проблема ожирения, как составляющая компонента МС, во всем мире за последние годы приобрела масштабы эпидемии, достигая 25–35% среди взрослого населения, несмотря на то, что в условиях современного мира большое внимание уделяется эстетическому моменту данной проблемы, а признаки МС в настоящее время в экономически развитых странах встречаются у 10–25% населения. Наличие МС в 2–4 раза увеличивает частоту внезапной смерти и развитие ССЗ, а риск формирования СД 2 типа повышается в 5–9 раз [1, 3, 5, 9, 11, 14].
В последние два десятилетия подход к этой проблеме стал медицинским, указывая на то, что избыток массы тела является не особым типом телосложения, обусловленным фактором, унаследованным от родителей, а должен рассматриваться как самостоятельное заболевание, требующее немедленного вмешательства грамотного специалиста. В клинической практике врачи различных специальностей довольно часто встречаются с МС, который представляет собой кластер гормональных и метаболических нарушений, объединенных общим патофизиологическим механизмом — ИР. Определенное время считалось, что МС — это удел лиц преимущественно среднего и пожилого возраста. Однако ряд проведенных исследований указывают, что за прошедшие два десятилетия МС демонстрирует устойчивый рост среди подростков и молодежи: частота встречаемости МС среди подростков за период с 1994 по 2000 гг. возросла с 4,2 до 6,4%, а избыток массы тела среди детского населения в экономически развитых странах был зарегистрирован в 12–14% случаев [10, 11].
Знание патофизиологических механизмов и лабораторное подтверждение ИР дают более широкие возможности для внедрения эффективных мероприятий, повышающих чувствительность тканей к инсулину, в том числе медикаментозное воздействие на метаболические нарушения, связанные с ИР. Это могло бы улучшить прогноз и снизить риск сердечно-сосудистых осложнений уже на ранних этапах, когда еще не сформировалось заболевание. Изменения в сосудистой стенке, а именно ее ригидность, эндотелиальная дисфункция, а затем микроангиопатии и ремоделирование сосудистого русла развиваются задолго до формирования АГ, ИБС и СД 2 типа со всеми их клиническими проявлениями. Так, для больного с высокими цифрами АД врач тут же предпринимает меры по оказанию помощи, а с пограничным уровнем АД рекомендуется наблюдение, хотя изменения в сосудистой стенке идентичны у обоих пациентов. Таким образом, обоснование МС как самостоятельного заболевания, обусловленного ИР, могло бы оптимизировать лечение его проявлений и разработать соответствующие стандарты по ведению МС как нозологической единицы [2, 3, 6, 9, 12, 15].
Принимая во внимание комплексный характер метаболического синдрома, становится понятным, почему до настоящего времени нет единых диагностических критериев обсуждаемой патологии. Существуют две основные группы диагностических критериев МС, предложенных Всемирной организацией здравоохранения в 1999 г. и Национальной образовательной программой США по холестерину в 2001 г.
В США было проведено исследование по выявлению частоты встречаемости МС по данным двух групп критериев NCEP ATP III (National Cholesterol Education Program) и ВОЗ. Так, согласно критериям NCEP ATP III метаболический синдром встречался у 23,9% обследуемых, сообразно же критериям ВОЗ он был выявлен у 25,1% лиц, включенных в исследование, что является сопоставимым. Следовательно, существенной разницы в предложенных двух группах диагностических критериев нет [4].
Международная федерация диабетологов (Internntional Diabetes Federation — IDF) предложила в 2005 г. комплекс диагностических критериев с целью выработки единого подхода к выявлению частоты встречаемости и сопоставимости результатов по исследованию МС:
-
Абдоминальное ожирение.
-
Атерогенная дислипидемия — повышение уровня триглицеридов и снижение концентрации холестерина липопротеидов высокой плотности, с увеличением уровня аполипопротеина В, появлением мелких частиц липопротеидов низкой плотности.
-
Артериальная гипертония, которая часто развивается при ожирении и инсулинорезистентности, хотя имеет многофакторное происхождение.
-
Инсулинорезистентность, имеющаяся у большинства больных с метаболическим синдромом, тесно ассоциирующаяся с другими метаболическими факторами риска и являющаяся фактором риска для сердечно-сосудистых заболеваний (стойкая инсулинорезистентность проявляется нарушением толерантности к глюкозе и в конечном итоге приводит к формированию сахарного диабета типа 2).
-
Воспалительное состояние, проявляющееся в повышении уровня С-реактивного белка (СРБ); одной из возможных причин увеличения его уровня считают ожирение, которое сопровождается высвобождением воспалительных цитокинов из жировой ткани.
-
Протромботическое состояние, характеризующееся увеличением уровней ингибитора-1 активатора плазминогена (PAI-1) и фибриногена; склонность к тромбозу и воспалительное состояние могут быть метаболически взаимосвязаны.
Весной 2005 г. IDF внесла некоторые более жесткие критерии в определение МС, что было представлено в апреле 2005 г. на I Международном конгрессе по предиабету и метаболическому синдрому в Берлине и на 75-м Конгрессе Европейского общества по атеросклерозу в Праге: окружность талии для европеоидов ≥ 94 см умужчин, ≥ 88 см у женщин; глюкоза плазмы натощак 5,6 ммоль/л или ранее диагностированный СД, абдоминальное ожирение — основной критерий диагностики МС.
Необходимость лечения ожирения на сегодняшний день является аксиомой! Подход к терапии должен быть комплексным, в зависимости от степени ожирения: при ИМТ до 30 кг/м2 нужны физические упражнения и диетические мероприятия, при ИМТ — > 30 кг/м2 — фармакотерапия, а при ИМТ 40 кг/м2 — следует задуматься о хирургическом вмешательстве.
Устойчивый эффект при немедикаментозном лечении ожирения в клинических условиях наблюдается приблизительно в 10% случаев. Основные направления немедикаментозного лечения ожирения — изменение стереотипа питания с ограничением калорийности пищи, увеличение физической активности (лечебная физкультура). Регулярные физические нагрузки повышают чувствительность тканей к инсулину, улучшают липидный спектр крови.
Суть низкокалорийной диеты — энергетическая ценность потребляемой пищи не должна превышать 1500 ккал в сутки, при этом физическая активность должна потреблять более 200 ккал в день — ходьба на свежем воздухе не менее 30 минут.
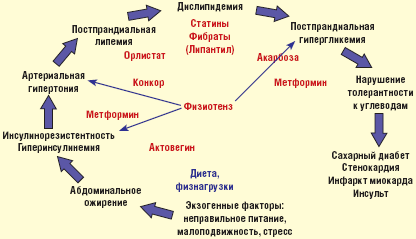
В фармакотерапии ожирения, сочетающегося с АГ, коррекция ИР является важным компонентом в общей схеме лечения МС (рис. 2).
Метформин — препарат группы бигуанидов, стимулирующих чувствительность клеточных рецепторов печени и периферических тканей (скелетная мускулатура) к эндогенному инсулину, не оказывает влияния на активность b-клеток поджелудочной железы.
Первичный, суммарный антигипергликемический эффект метформина вызван снижением продукции глюкозы печенью (глюконеогенез) и свободных жирных кислот (СЖК), через подавление окисления жира, с усилением периферического захвата глюкозы.
Гипогликемическая реакция печени на метформин обусловлена в первую очередь подавлением процессов глюконеогенеза и в меньшей степени — гликогенолиза, что в конечном итоге манифестируется гликемией натощак. Подобный эффект метформина на уровне печени обусловлен ингибированием поступления в гепатоциты предшественников глюкозы (лактат, пируват, аминокислота) и ключевых ферментов глюконеогенеза (глюкоза-6-фосфат, фруктоза-1,6-биофосфатаза, пируваткарбоксилаза).
Восстановление чувствительности к инсулину периферической ткани под действием метформина реализуется через ряд клеточных механизмов: увеличивается количество аффинных к инсулину рецепторов, через стимуляцию тирозинкиназы повышается активность инсулиновых рецепторов, активизируются экспрессия и перемещения из внутриклеточного пула на клеточную мембрану транспортеров глюкозы (ГЛЮТ 1–5).
Другими механизмами действия метформина являются снижение гастроинтестинальной абсорбции глюкозы с повышением анаэробного гликолиза, что сопровождается снижением уровня глюкозы в крови, оттекающей от кишечника, с одновременным снижением содержания инсулина («тощаковая» инсулинемия) в сыворотке крови, что суммарно приводит к снижению постпрандиальной гликемии. С учетом указанных механизмов действия метформина правильнее говорить не о его гипогликемическом, а об антигипергликемическом влиянии [5, 13, 14].
Агонисты I1-имидазолиновых рецепторов (Физиотенз) занимают особое место в терапии МС при коррекции АГ через подавление центральной гиперсимпатикотонии. Эти препараты, за счет активации имидазолиновых рецепторов 1-го типа в среднем мозге и в меньшей степени пресинаптических α2-адренорецепторов, уменьшают центральную симпатическую импульсацию, способствуют снижению гидролиза жиров, уменьшению СЖК, усилению метаболизма глюкозы и повышению чувствительности к инсулину, снижению уровня триглицеридов (ТГ), повышению липопротеинов высокой плотности (ЛПВП) и снижению уровня ИАП-1. В исследованиях H. Lithell (1999 г.) получены данные о влиянии Физиотенза (моксонидина) на уменьшение ИР. В пилотном исследовании В. А. Алмазова (2000 г.) также подтверждено влияние Физиотенза на ИР. Данные исследования определили способность Физиотенза влиять на ИР у пациентов с избыточным весом и с НТГ.
Было проведено сравнительное исследование ALMAZ среди 202 пациентов с АГ и избыточной массой тела (рандомизированные группы по 101 пациенту): лечение — Физиотенз (моксонидин — 0,4 мг в сутки) и Метформин (1000 мг в сутки) в течение 4-х месяцев. Критерии включения пациентов в исследование — возраст > 40 лет, ИМТ > 27 кг/м2, глюкоза натощак > 6,1 ммоль/л.
Исследование ALMAZ показало, что Физиотенз (моксонидин) снижал уровень глюкозы натощак, ИР, вес пациентов, повышал скорость утилизации глюкозы. Была также проведена оценка влияния моксонидина и метформина на гликемический контроль у пациентов с избыточным весом, мягкой АГ, ИР и НТГ.На фоне моксонидина уровень глюкозы натощак снижался менее выражено, чем на фоне метформина, но достоверно снижался уровень инсулина, в то время как метформин на него не влиял, а ИМТ снижался равнозначно на фоне обоих препаратов [4, 9, 15].
Оба препарата статистически достоверно повышают чувствительность к инсулину после нагрузки глюкозой: моксонидин оказывает влияние на уровень инсулина в крови, метформин регулирует уровень глюкозы, что сопровождалось снижением гликозилированного гемоглобина (Нв). Оба препарата статистически достоверно снижали массу тела, оставаясь метаболически нейтральными к липидам.
С целью коррекции нарушений липидного обмена, помимо немедикаментозной терапии, ряду пациентов при индексе массы тела более 27 кг/м2 требуется назначение липидснижающих лекарственных средств. С учетом конкретной ситуации и типа дислипидемии в настоящее время рекомендовано пять категорий гиполипидемических лекарственных препаратов (различия в их эффектах на липидный спектр хорошо известны):
-
фибраты;
-
секвестранты желчных кислот;
-
никотиновая кислота и ее производные (ниацин);
-
орлистат (ингибиторы абсорбции холестерина (ХС) — желудочно-кишечной липазы);
-
ингибиторы ГМГ-КоА-редуктазы (статины).
Статины — ингибиторы редуктазы 3-гидрокси-3-метилглутарила — кофермента А (ГМГ-КоА) тормозят синтез ХС в печени и кишечнике, путем компенсаторной экспрессии гепатоцитами повышенного числа рецепторов липопротеидов низкой плотности (ЛПНП) и увеличения клиренса ХС ЛПНП из плазмы. Убедительно доказанная прогностическая польза длительного приема ингибиторов ГМГ-КоА-редуктазы при атеросклерозе и сахарном диабете уверенно вывела эту группу препаратов на ведущее место в рекомендациях по современной медикаментозной терапии и профилактике сердечно-сосудистых заболеваний при МС [2, 3, 5].
По данным экспериментальных работ и клинических исследований, с учетом плейотропности статинов (симвастатин, аторвастатин, правастатин и др.), установлены несколько эффектов, оказывающих влияние на патогенез и течение МС: «противовоспалительные», иммуномоделирующие (через снижение в плазме интерлейкина-6 и ФНО-α), увеличение мозгового натрийуретического гормона, усиление секреции NO эндотелием сосудов.
Статины, зарегистрированные в европейских странах, представлены в табл. 2:

В последние годы привлекает новая группа препаратов, воздействующих на эндоканнабиноидную систему, — блокаторов СВ1 эндоканнабиноидных рецепторов. Эндоканнабиноидная система у здорового человека обычно находится в «немом» состоянии, активируясь «по требованию» под воздействием стресса. Основные последствия активации этой системы состоят в нарушении терморегуляции, регулировании тонуса гладких мышц и АД, ингибировании моторного поведения — усиление боли и тревоги, стимулирование аппетита и никотиновой зависимости (получение удовольствия от приема пищи и курения).
Рецепторы к каннабиноидам были открыты во время поисков точек приложения действия основного производного конопли (CANNABIS) — дельтатетрагидроканнабинола. К настоящему времени описаны два типа рецепторов СВ1 и СВ2. Рецепторы СВ1 обнаружены в головном мозге (гипокампе, базальных ганглиях, коре, мозжечке, гипоталамусе, лимбических структурах, стволе головного мозга). Рецепторы СВ2 локализуются на мембранах клеток иммунной системы.
Эндоканнабиноиды образуются из фосфолипидов-предшественников, локализованных в мембранах клеток «по требованию». Они действуют локально и немедленно метаболизируются после того, как реализовали свой эффект. Являясь системой «немедленного реагирования», у здоровых людей эндоканнабиноидная система очень быстро активируется и также быстро «засыпает», действуя на уровне мозга, она индуцирует избыточное потребление пищи и потребность в никотине; действуя на уровне адипоцитов — стимулирует накопление жира.
Блокаторы СВ1-рецепторов устраняют неблагоприятные эффекты гиперактивности эндоканнабиноидной системы. Римонабант (препарат в России не зарегистрирован) — уже применялся в нескольких многоцентровых рандомизированных плацебо-контролируемых исследованиях у больных ожирением и продемонстрировал обнадеживающие результаты в отношении снижения массы тела, улучшения липидного профиля и контроля гликемии у пациентов с СД. Немаловажным фактором является то, что применение СВ1-блокаторов способствует отказу от курения. Однако требуются ответы еще на многие вопросы, в том числе касающиеся безопасности, прежде чем этот класс препаратов войдет в широкую клиническую практику [6].
Таким образом, лечение МС, компонентами которого являются ожирение и АГ, носит комплексный характер: снижение массы тела, восстановление чувствительности клеток органов-мишеней к инсулину, коррекция уровня АД, нормализация гликемического и липидного профилей крови. Коррекцию атерогенной дислипидемии при МС можно проводить как статинами, так и фибратами, в зависимости от конкретной ситуации, до достижения оптимального липидного спектра крови. Важным требованием к гипотензивным препаратам при МС является их метаболическая нейтральность.
По вопросам литературы обращайтесь в редакцию.
А. М. Шилов, доктор медицинских наук, профессор
А. С. Авшалумов
А. С. Галанова
В. Б. Марковский
Е. Н. Синицина
ММА им. И. М. Сеченова, Клиника кибернетической медицины, Москва
