Генетические и иммунологические маркеры воспалительного процесса при муковисцидозе у детей
В настоящее время интенсивные иммунологические исследования позволили выявить общие закономерности в патогенезе ряда заболеваний, которые прежде не связывали друг с другом. Обобщение полученных данных привело к формированию концепции об иммуноопосредованных воспалительных заболеваниях. Выделяют заболевания, ассоциированные с Th1, Th2-лимфоцитами и заболевания, ассоциированные с воспалительными цитокинами [1]. В рамках последних обсуждается и хроническая обструктивная болезнь легких. Существует мнение, что хронический воспалительный процесс при муковисцидозе (МВ) поддерживается за счет дисбаланса про- и противоспалительных цитокинов [2].
В то же время несомненный интерес представляет дальнейшее углубленное изучение детоксицирующих систем организма у больных, страдающих МВ, в частности, микро- и макрофагального звеньев иммунитета. Причины изменения активности фагоцитирующих клеток (нейтрофилы, макрофаги) остаются изученными недостаточно. Используя современные методы исследования рецепторного аппарата клеток и ферментативного статуса фагоцитов на разных этапах развития патологического процесса, можно получить важную информацию о механизмах иммунного воспаления при этом заболевании и обосновать подходы к иммунокоррекции данного заболевания.
В связи с приведенными фактами были поставлены следующие задачи:
-
Выявить ассоциацию полиморфных генетических маркеров генов модификаторов иммунного ответа: интерлейкина 1 b (IL1В – + 3953А1/А2), антагониста рецептора интерлейкина 1 (IL1RN — VNTR), интерлейкина 4 (IL4 — 3’-UTR G/C), a–субъединицы рецептора интерлейкина 4 (IL4RA — I50V) с муковисцидозом и их влияние на варьирование иммунологических признаков (цитокины, их рецепторы и антагонисты) и эффективность проводимой терапии.
-
Изучить содержание секреции цитокинов в крови у больных МВ, супернатанте культуры моноцитов-макрофагов (Мн — Мф).
Исследуемая популяция
В исследование были включены 24 больных с МВ. Все дети были обследованы по общим клиническим методикам согласно стандартам, рекомендованным для данной категории больных [3]. Проведено иммунологическое обследование, включающее оценку функциональной активности моноцитов-макрофагов и определение цитокинового профиля (про- и противовоспалительные цитокины) 21 пациенту (в возрасте от 5 до 17 лет).
В контрольную группу для иммунологических исследований вошло 20 практически здоровых детей того же возраста, не болевших ОРЗ в течение последних 2 мес перед обследованием. В контрольную группу для проведения генетических исследований вошли 129 здоровых русских жителей г. Томска. Определение полиморфных генетических маркеров генов проводили на базе НИИ медицинской генетики ТНЦ СО РАМН, г. Томск, иммунологическое обследование в отделе гематологии, иммунологии и морфологии ЦНИЛ СибГМУ.
Методы исследования
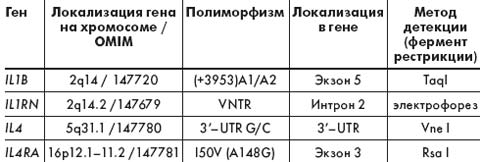
Для выполнения молекулярно-генетического анализа производили выделение тотальной ДНК из цельной крови с помощью стандартного метода фенол-хлороформной экстракции. Генотипирование полиморфных маркеров изучаемых генов осуществляли с помощью ПЦР и ПДРФ-анализа по опубликованным ранее методикам. Характеристика исследованных полиморфизмов генов представлена в табл. 1.
Исследование содержания цитокинов (ИЛ-1β, ФНО-α, ИЛ-4, ИЛ-10, антагониста рецептора ИЛ-1 и ИФН-γ) в сыворотке крови и супернатанте культуры моноцитов-макрофагов [4, 5] проводили с помощью метода иммуноферментного анализа. Определение ИЛ-1b, ФНО-a, ИЛ-4, ИЛ-10, ИФН-g проводили с помощью наборов фирмы ООО «Протеиновый контур» (г. Санкт-Петербург), антагониста рецептора ИЛ-1 — наборами фирмы «Вектор-Бест» (г. Новосибирск). Учитывая, что макрофаги являются прилипающими клетками, для определения их функциональной активности использовали монослой этих клеток на стекле (Romans D. et al, 1976).
Методы статистической обработки
Для проверки соответствия распределения генотипов ожидаемому при равновесии Харди–Вайнберга (РХВ), сравнения частот аллелей и генотипов, оценки связи аллелей генов с МВ использовали критерий χ2 Пирсона с поправкой Йетса на непрерывность при числе степеней свободы равном 1, а также двусторонний точный тест Фишера в случае, если ожидаемое значение хотя бы в одной ячейке таблицы сопряженности было меньше 5. Кроме того, об ассоциации с патологическим фенотипом различных генотипов (или их комбинаций) и аллелей судили по величине отношения шансов (Оdds Ratio (OR)), которое показывает, во сколько раз выше вероятность заболеть для индивида с определенным генотипом (или комбинацией генотипов) [18].
Математическую обработку результатов исследования проводили с использованием описательных статистик: Ме (медиана) и Q1–Q3 (quarite 1–3). Для определения достоверности различий качественных признаков использовали анализ таблиц сопряженностей с вычислением точного значения критерия χ2 и точного критерия Фишера [6]. Для анализа количественных признаков при сравнении двух независимых выборок применяли критерий Манна–Уитни, при сравнении трех и более выборок — Н-критерий Краскола–Уолисса. При достоверности межгрупповых различий проводили попарные сравнения с использованием Z-критерия Краскола–Уолисса с поправкой на множественные сравнения [7]. При сравнении двух зависимых выборок применяли критерий Вилкенсона, при сравнении трех и более зависимых выборок — Q-критерий Фридмана; для попарных сравнений — критерий Ньюмена–Кейлса [7]. Для расчета использовали статистический пакет SAS 8.
Результаты и их обсуждение
Обследовано 24 больных с МВ, находившихся под наблюдением в детской больнице № 1. Из них 9 девочек и 15 мальчиков. По возрасту дети были распределены следующим образом: с года до 4-х лет — 5 (20,8%) человек, с 5 до 15 лет — 14 (58,2%), с 15–18 лет — 2 (8%), подростки старше 18 лет — 3 (13%). Преимущественно легочная форма МВ выявлена у 5 (21%) пациентов, преимущественно кишечная форма — у 1 (4%), смешанная форма — у 18 (75%) пациентов. До одного года диагноз установлен 5 детям (21%), от 3–6 лет — 16 (67%), старше 6 лет — 3 (12%) больным. По результатам неонатального скрининга диагноз был поставлен трем детям.
Хроническая синегнойная инфекция была диагностирована у 4 (17%) детей с МВ, все они имели сформировавшиеся бронхоэктазы, дыхательная недостаточность выявлена у 3 (12%), хронический панкреатит у 12 (50%) детей, жировой гепатоз — у 3 (12%), формирующийся цирроз печени у 4 (17%), нутритивная недостаточность у 4 (17%), задержка роста у 4 (17%), остеопенический синдром — у 2 (8%) больных.
При изучении полиморфизма генов модификаторов иммунного ответа (IL1B, IL1RN, IL4, IL4RA) у больных МВ и в контрольной группе были выявлены следующие особенности. В контрольной выборке русских жителей г. Томска распределение генотипов практически всех изученных полиморфных вариантов соответствовало ожидаемому при равновесии Хайди–Вайнберга (табл. 2). Отклонение было выявлено лишь по VNTR полиморфизму гена IL1RN за счет недостатка гетерозигот А1А2. В выборке детей, больных МВ, распределение генотипов по всем изученным полиморфизмам соответствовало ожидаемому при РХВ. Выявлена ассоциация VNTR полиморфизма гена IL1RN с МВ (ОR = 2,14; р = 0,033). Для других изученных маркеров генов модификаторов иммунного ответа связи с заболеванием получено не было.
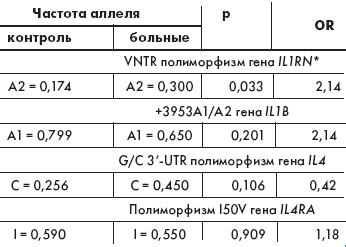
Величина ОR при сравнении частоты генотипа А1А2 против остальных генотипов у больных МВ составила 6,93 (95% CI: 1,54–32,72; c2 = 7,49, р = 0,006). Возможно, хронический воспалительный процесс при МВ связан с VNTR полиморфизмом рецепторного антагониста ИЛ-1, выполняющего функцию специфического блокатора биологического действия изучаемого провоспалительного цитокина, что способствует прогрессированию патологического процесса. Для VNTR полиморфизма гена IL1RN ранее была выявлена связь с хроническим гнойным риносинуситом, туберкулезом, сепсисом, вирусным гепатитом С, остеопорозом, аутоиммунными заболеваниями (сахарный диабет 1 типа, аутоиммунный тиреоидит), также характеризующимися хроническим воспалением различной этиологии и часто сочетающимися с МВ [1, 9, 10, 13].
Нами была изучена характеристика цитокинового статуса у больных МВ. Обнаружено увеличение в сыворотке крови уровня ФНО-α, на фоне снижения противоспалительных цитокинов: ИЛ-10 и в большей степени антагониста рецептора ИЛ-1. Повышенное содержание ФНО-α в изучаемых средах имеет важное значение в поддержании воспаления, в том числе при МВ [2]. Известно, что при остром воспалении ФНО-α стимулирует хемотаксис нейтрофилов в очаг воспаления, увеличивает тропность последних к эндотелиоцитам за счет индукции молекул адгезии как на поверхности эндотелиальных клеток, так и на нейтрофилах [8, 9]. ФНО-α играет роль в хронизации процесса за счет повышения адгезии макрофагов, которые являются основными клетками-эффекторами хронического воспаления, и опосредованно за счет активации тромбоцитов, индукции синтеза оксида азота [10, 11]. Избыточное образование цитокина способствует развитию токсического септического шока, гипертермии, кахексии, полиорганной недостаточности, что может наблюдаться у больных МВ при тяжелом течении заболевания. В связи с вышеизложенным в терапии больных МВ оправдано использование стероидных и нестероидных лекарственных средств, в том числе альтернирующего курса преднизалона.
До недавнего времени одной из главных причин неблагоприятного течения тяжелых форм МВ, хронических заболеваний легких с гнойно-септическими заболеваниями считали неконтролируемую продукцию различных медиаторов воспаления и в первую очередь провоспалительных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-8, ИФН-γ), с действием которых связывали развитие бактериально-токсического шока, дистресс-синдрома, ДВС-синдрома [12–16].
В результате исследования выявлено выраженное снижение противовоспалительного цитокина — антагониста рецептора ИЛ-1 (IL1Ra) до 2,57 (1,46–6,46) нг/мл, в контроле 11,7 (9,9–13,3) нг/мл (р < 0,009), который ингибирует пути связывания ИЛ-1α, и ИЛ-1β с соответствующими клеточными рецепторами. Полученные результаты свидетельствуют о выраженном и плохо контролируемом воспалительном процессе в организме больных с МВ. Содержание IL1Ra в сыворотке крови и супернатанте Мн-Мф при стимуляции бактериальным агентом (ЛПС-комплексом) статистически значимо отличалось от соответствующих показателей детей контрольной группы (р < 0,001).
В 1996–1997 гг. сформировалась концепция [16], согласно которой вслед за начальным высвобождением провоспалительных медиаторов в организме больного индуцируется запуск противовоспалительной реакции. Обозначенная как синдром компенсаторного противоспалительного ответа (CARS, compensatory anti-inflamatory response syndrome), противовоспалительная реакция направлена на снижение синтеза или модуляцию эффектов провоспалительных медиаторов, ослабление проявления системного воспаления и восстановление исходного гомеостаза. Однако чрезмерная выраженность CARS может индуцировать развитие глубокой иммунодепрессии, что приводит к полной неспособности организма противостоять бактериальной агрессии и часто обозначается как состояние «иммунопаралича» [17]. Свидетельством несостоятельности иммунной защиты в этом случае является хронизация или диссеминация инфекции, смена патогенной флоры с развитием микст или нозокомиальной инфекции, нарушение процессов репарации.
В свете такого представления патогенеза инфекционно-воспалительного процесса и полученных нами данных становится ясно, что баланс про- и противовоспалительных реакций должен учитываться при выборе средств и методов иммунокорригирующей терапии. Представляют интерес результаты сравнительной характеристики содержания цитокинов у пациентов с отсутствием и наличием бронхоэктазов, при этом последние сочетались с синегнойной инфекцией. Для больных МВ с бронхоэктазами характерно статистически значимое повышение ИЛ-1β в сыворотке крови: 128,8 (125,7–131,8) нг/мл против 12,7 (8,3–42,5) нг/мл в группе без бронхоэктазов (р = 0,04). При этом отмечено снижение спонтанной продукции ИЛ-10 Мн-Мф крови до 22 (17,6–26,4) нг/мл против 147 (135,4–165,7) нг/мл в группе без сформировавшихся бронхоэктазов (р = 0,04), а также стимулированной секреции данного цитокина: 15,55 (10,29–20,8) нг/мл против 118,9 (101,6–151,8) нг/мл в группах сравнения (р = 0,04). Высокий уровень ИЛ-1β косвенно свидетельствует о формировании бронхоэктазов у детей с МВ при наличии синегнойной инфекции.
Отмечено, что у больных с МВ имело место снижение уровня ИФН-γ: 17,01 (10,98–23,29) нг/мл против 50,79 (49,9–51,40) нг/мл в сыворотке крови и в ЛПС — стимулированном супернатанте культуры Мн-Мф по сравнению с контрольными значениями (р < 0,001), что играет роль в ослаблении противовирусного и клеточного иммунитета.
Изучение функциональной активности моноцитов-макрофагов показало, что после стимуляции ЛПС комплексом, имитирующим бактериальный агент, Мф начинают более активно продуцировать ИЛ-4, но показатель остается ниже уровня здоровых детей. Секреция ИЛ-4 Мн-Мф у детей контрольной группы (здоровые пациенты) на стимуляции ЛПС комплексом не изменялась. Таким образом, моноциты-макрофаги у больных МВ на стимуляцию бактериальным агентом (ЛПС комплекс) активно продуцируют ИЛ-4, запускающий Th2-путь иммунного ответа, это, в свою очередь, стимулирует повышенную выработку IgE и способствует формированию гиперреактивности бронхов. Полученные данные подтверждают мнение о формировании бронхообструкции [4] при повторных встречах с бактериальными агентами и необходимости включения в стандарты терапии β2 –агонистов.
В рамках данной работы было исследовано влияние Пульмозима на состояние цитокинового статуса детей с МВ. Обследовано 17 детей с МВ в возрасте от 1 года до 16 лет. Больные получали Пульмозим через день в дозе 2,5 мг в сутки. Срок наблюдения составил 6 месяцев.
Результаты исследования показали, что пациенты, получавшие Пульмозим, отмечали увеличение количества мокроты и отделяемого из носа в первые 3–5 дней терапии при уменьшении ее вязкости. Через 1 мес полностью прекратился кашель у 75% пациентов, у 25% детей (с тяжелой формой МВ) сохранялся редкий кашель со значительным уменьшением количества мокроты. Количество обострений заболевания в катамнезе сократилось в 3 раза. Применение ингаляций в рамках стандартного лечения больных МВ способствовало увеличению содержания IL1Rа в сыворотке крови и супернатанте, а также повышению спонтанной выработки ИФН-γ макрофагами на фоне снижения количества обострений заболевания (табл. 3).
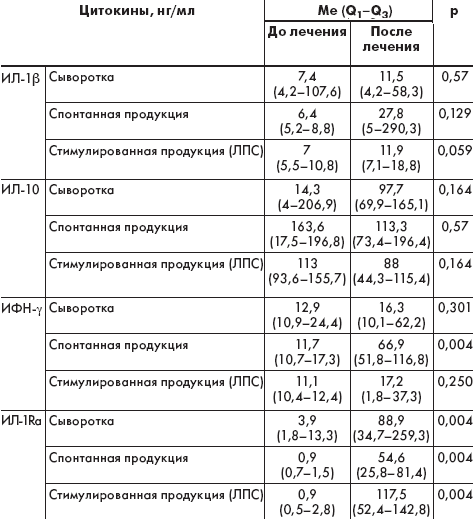
Таким образом, при муковисцидозе в детском возрасте отмечается дисбаланс между про- и противовоспалительными цитокинами: повышение ИЛ-1β, ФНО-α, на фоне снижения ИЛ-10 и ИЛ-4, особенно выраженный у больных с синегнойной инфекцией и бронхоэктазами. Получена ассоциация VNTR полиморфизма гена IL1RN с муковисцидозом — OR = 2,14 (р = 0,033). Снижение уровня ИНФ-γ в сыворотке крови и его продукции макрофагами на фоне стимуляции ЛПС комплексом у больных МВ может свидетельствовать о снижении клеточного иммунного ответа по Th1-пути и противовирусной защиты. Полученные результаты предполагают назначение препаратов интерферона или его индукторов для профилактики и лечения обострений заболевания. Применение Пульмозима способствует повышению содержания в крови противовоспалительного цитокина IL1Rа и выработке макрофагами ИНФ-γ, вследствие чего сокращается число обострений заболевания.
По вопросам литературы обращайтесь в редакцию.
Е. И. Кондратьева, доктор медицинских наук, профессор
Г. Н. Янкина, кандидат медицинских наук
А. А. Рудко, кандидат медицинских наук
Е. В. Яровенко
Т. В. Перевозчикова, кандидат медицинских наук
М. А. Скачкова, доктор медицинских наук, профессор
В. Н. Сероклинов, кандидат медицинских наук
Сибирский государственный медицинский университет, Томск
ГУ НИИ медицинской генетики ТНЦ СО РАМН, Томск
Оренбургская государственная медицинская академия Росздрава
Алтайский государственный медицинский университет
