Альтернативные направления в терапии больных вирусными гепатитами
Проблема вирусного гепатита С (HCV), особенно в последние годы, стала одной из самых актуальных в современной медицине. В настоящее время уже ясно, что гепатит С является важнейшей проблемой современной инфектологии, так как эпидемиологическая ситуация в мире, обусловленная быстрым его распространением, становится все более тревожной. Согласно последним данным, в мире насчитывается свыше 500 млн человек, инфицированных вирусом гепатита C.
Инфекционный процесс протекает в двух вариантах:
- манифестная форма HCV-инфекции — острый гепатит в желтушной или безжелтушной форме, но обязательно с симптомами гепатита (интоксикация, астеновегетативный, диспептический синдром, увеличение печени и селезенки и т. д.);
- бессимптомная (субклиническая) форма HCV-инфекции, когда отсутствуют жалобы и симптомы гепатита.
Острые манифестные формы HCV-инфекции (желтушная и безжелтушная) протекают как острый гепатит С с различной степенью тяжести заболевания (легкой, среднетяжелой, тяжелой и злокачественной). В ряде случаев наблюдается затяжное течение с длительной гиперферментемией и/или с затяжной желтухой (холестатический вариант).
В дальнейшем заболевание приводит либо к выздоровлению (15–25% случаев), либо к формированию хронической инфекции, протекающей по типу хронического гепатита с различной степенью активности.
Бессимптомная (субклиническая) форма HCV-инфекции является наиболее распространенной (до 70% всех случаев инфицирования), однако практически не диагностируется в период острой фазы. В дальнейшем субклинические формы (как и острые манифестные) завершаются выздоровлением или формированием хронического гепатита с различной степенью активности.
Таким образом, основной процент всех хронических поражений печени приходится на хроническую HCV-инфекцию, т. е. более чем у 50–75% инфицированных HCV людей в конечном итоге возникает хронический гепатит С (ХГС). При этом у каждого пятого развивается цирроз печени, а у каждого двадцатого — гепатоцеллюлярная карцинома.
Патогенез HCV-инфекции связан с прямым цитотоксическим действием вируса и нарушениями иммунологических реакций, что приводит к повреждению печени и других органов. Выявлена репликация HCV вне печени — в первую очередь, в иммунокомпетентных клетках (лимфоцитах), что снижает эффективность клеточного иммунитета и приводит к постепенному усилению вирусной инфекции.
Альфа-интерферон (α-ИФН) является базовым препаратом в лечении гепатита С с тех пор, как был открыт вирус гепатита С. В течение следующих 10 лет исследователи сфокусировали внимание на поиске оптимальных доз и длительности применения α-ИФН и подборе его комбинаций с другими препаратами.
Основное внимание было уделено синтетическим аналогам нуклеозидов. В настоящее время установлено, что наиболее эффективным из них в лечении гепатита С является рибавирин, вдвое увеличивающий эффективность монотерапии α-ИНФ.
Однако механизм действия рибавирина имеет существенный недостаток, так как репликация подавляется не у всех вирусных частиц, а в пуле всегда находятся вирионы, способные «ускользать» от воздействия ингибитора и воспроизводить мутантные штаммы.
Наибольшие успехи в лечении ХГС были достигнуты при проведении комплексной терапии с использованием пегинтерферона и рибавирина. При этом частота устойчивого вирусологического ответа увеличивается до 60–70% [1, 2, 3, 4].
В то же время число побочных эффектов существенно выше, поэтому больных, которым приходилось отменять противовирусную комплексную терапию с пегинтерфероном, в 3 раза больше, чем при аналогичной терапии с обычным α-ИФН [1].
Интерфероны обладают достаточно большим количеством побочных эффектов, в связи с чем нередко требуется снижение дозы или отмена назначенной терапии.
К числу побочных эффектов интерферонов относятся:
- гриппоподобный синдром;
- тромбоцитопения, лейкопения, анемия.
Возможны осложнения:
- со стороны нервной системы;
- со стороны сердечно-сосудистой системы;
- со стороны желудочно-кишечного тракта и печени;
- аллергические реакции.
В последние годы выяснилось, что недостаточная эффективность лечения гепатита С интерферонами и аналогами нуклеозидов обусловлена неспособностью организма реализовать полноценную иммунную реакцию — в первую очередь Т-клеточного типа в ответ на их введение [1, 5]. По данным исследований, у больных ХГС до лечения активность Т-хелперов CD4+(Th1) была низкой или вовсе отсутствовала. В ответ на монотерапию α-ИФН специфическая активность Th1 возрастала, но оставалась низкой, непостоянной и постепенно нивелировалась.
При этом в ответ на комбинированную терапию пегинтерфероном (пег-ИФН альфа-2а) и рибавирином у больных с полным, устойчивым ответом на нее отмечалась выраженная, непрерывная и длительная мультиспецифическая реакция специфических CD4+-клеток, сопровождающаяся существенным повышением продукции γ-ИФН.
Однако у больных, не ответивших на лечение или имевших рецидивы, отмечалась сначала такая же выраженная реакция CD4+-специфических клеток, которая затем уменьшалась или вообще исчезала.
Эти новые данные подчеркивают необходимость поиска и внедрения в инфектологию биологически активных препаратов, с одной стороны, способных к длительной активации специфических реакций Т-клеточного иммунитета, усилению активности В-лимфоцитов и макрофагов, с другой — обладающих собственной противовирусной активностью. При этом одним из важнейших требований к таким препаратам является отсутствие значимых побочных эффектов при длительном и, возможно, многолетнем применении.
В связи с этим постоянно предпринимаются попытки поиска альтернативных препаратов для лечения больных гепатитом С.
Одно из таких направлений терапии — применение препаратов, обладающих гепатопротекторным действием. В большинстве случаев в их состав входят эссенциальные фосфолипиды, которые выполняют следующие функции:
- восстанавливают целостность наружной и внутриклеточных мембран;
- восстанавливают текучесть мембран и поляризацию фосфолипидов;
- восстанавливают антигенную структуру мембран;
- нормализуют метаболизм и транспорт липидов.
Другое альтернативное направление лечения — применение глицирризиновой кислоты (ГК), получаемой из корня солодки обыкновенной [6, 7, 8, 9, 10, 11, 18].
Первые препараты на основе ГК были получены и применяются в странах Юго-Восточной Азии. Биологические эффекты ГК многочисленны:
- противовоспалительный;
- противоаллергический;
- противовирусный;
- гепатопротекторный;
- иммуномодулирующий;
- антиоксидантный.
Уже более 20 лет ГК с успехом применяется в Японии и других странах при лечении вирусных гепатитов в составе инъекционного препарата Неоминофаген С (SNMC), включающего также аминокислоты, которые усиливают действие ГК и снижают побочные эффекты α-ИНФ при совместном применении.
Выявлено гепатопротекторное действие ГК при вирусных гепатитах — как при монотерапии [12, 13], так и в комбинации с урсодеоксихолевой кислотой [14] и эссенциальными фосфолипидами [15]. При этом у больных отмечали быструю нормализацию аминотрансфераз и улучшение гистологических маркеров гепатита.
В отдельном исследовании показано, что применение ГК непрерывно в течение 10 лет более чем в 2 раза снижало частоту возникновения гепатоцеллюлярной карциномы у больных ХГС [10]. Особый интерес представляют клинические исследования по комбинированной терапии гепатита С с применением ГК и α-ИНФ у больных, не ответивших на предшествующую монотерапию α-ИНФ. В этих исследованиях было показано, что уже после 12 нед лечения элиминацию рибонуклеиновой кислоты (РНК) HCV в 3 раза чаще наблюдали в группе больных, применявших ГК и α-ИНФ, чем в группе больных, продолжавших монотерапию α-ИНФ [16, 17].
Показано, что иммуномодулирующий и противовирусный эффект ГК обусловлен активацией Т-лимфоцитов, усилением их пролиферации, продукции интерлейкина (IL2), экспрессией IL-2R специфических рецепторов и опосредованным усилением выработки γ-ИФН [9, 11].
Следует отметить, что большинство эффектов при лечении вирусных гепатитов было получено при использовании инъекционной формы ГК. Эффективность терапии вирусных гепатитов при пероральном применении ГК показана лишь в ограниченном числе работ [19, 20].
Наибольшее распространение в нашей стране получили препараты, в состав которых входят эссенциальные фосфолипиды: Эссенциале, Эссенциале Н, Лецитин, Фосфолип, Липостабил, Фосфоглив.
Сейчас в терапию больных гепатитом С включают препараты, в состав которых входит ГК (они представлены ниже):
- Фосфоглив — капсулы (0,5 г), 65 мг фосфатидилхолина и 35 мг ГК, флаконы (2,5 г), 500 мг фосфолипида и 200 мг глицирризина;
- Виусид — пакеты (3,2 г), 40 мг ГК;
- Неоминофаген С (SNMC) — ампулы (20 мл), 40 мг глицирризина.
И только один препарат включает в себя эссенциальные фосфолипиды и ГК — это отечественный гепатопротектор с противовирусной активностью — Фосфоглив.
Фосфоглив, сочетая свойства гепатопротектора (за счет эссенциальных фосфолипидов), обладает противовирусной активностью (за счет ГК) и, в отличие от препаратов, разработанных ранее, является принципиально новым. Проведенные ранее исследования показали его эффективность при лечении больных вирусными гепатитами [14, 15, 19, 20, 21].
В данном исследовании сравнивалась эффективность монотерапии различными препаратами на основе глицирризиновой кислоты у больных ХГС.
Все наблюдаемые были мужского пола в возрасте от 20 до 38 лет; длительность заболевания составляла от 2 до 5 лет у 64% обследованных, у остальных больных достоверно не установлена (антитела к HCV у них выявлены в результате скрининговых обследований).
У всех больных уровень аланиновой трансаминазы (АЛТ) в крови превышал две и более нормы, а по данным УЗИ определялись диффузные изменения в печени. Вирусная нагрузка, определенная методом полимеразной цепной реакции (ПЦР), была более 2 млн копий (5+ в разведении 1 : 10000). Биопсия не проводилась. В исследование включались пациенты с различными генотипами вируса. Назначались Виусид и Фосфоглив.
Контрольную группу составили больные в количестве 15 человек, не получавшие противовирусного лечения — им назначалась базисная терапия.
В состав Виусида входят антивирусные компоненты (ГК — 40 мг, глюкозамин — 700 мг, яблочная кислота — 400 мг), а также аминокислоты, витамины, вспомогательные вещества.
Виусид назначали по 3,2 г 3 раза в сутки; общая продолжительность курса лечения составляла 12 нед. Суммарно больные принимали по 840 мг ГК в неделю. Виусид перорально получали 12 человек.
У 12 пациентов в течение 12 нед проводилась монотерапия Фосфогливом внутривенно.
В состав Фосфоглива входят: ГК — 200 мг, фосфатидилхолин — 500 мг, вспомогательные вещества (мальтоза) — 1800 мг.
Фосфоглив назначали по 5,0 г (2 флакона) 3 раза в неделю; предварительно растворив содержимое каждого флакона в 10 мл воды для инъекций, вводили препарат внутривенно медленно. Таким образом, больные получали по 1200 мг ГК в неделю.
Анализ клинической симптоматики показал, что у больных, которым проводилась монотерапия Фосфогливом или Виусидом, достоверно быстрее — по сравнению с контрольной группой (12 ± 2) — исчезала тошнота: 1,3 ± 0,2 и 4 ± 0,5 дня соответственно. При монотерапии Виусидом пациенты отмечали улучшение аппетита через 3 ± 0,4 дня после начала приема препарата. У больных, принимавших Фосфоглив, аппетит нормализовался через 3,6 ± 1 день. У пациентов контрольной группы анорексия исчезала лишь через 9 ± 1 день. Слабость и снижение работоспособности у больных, находящихся на базисной терапии, продолжались до 12 ± 2 дня, в группах, где применяли Фосфоглив и Виусид, достоверно короче — соответственно 4 ± 1 и 3 ± 1 день.
Более быстрая и достоверная нормализация трансаминаз по сравнению с контрольной группой отмечена у больных, получавших лечение препаратами ГК.
Так, при применении Виусида снижение АЛТ до верхней границы нормы наблюдалось уже через 15 ± 1,2 дня, Фосфоглива — 16 ± 2 дня от начала лечения; на базисной терапии снижение ферментов заняло более 60 дней (рис. 1).
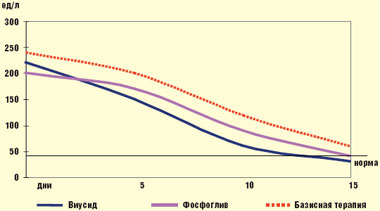
|
| Рис. 1. Динамика АЛТ у больного ХГС |
Определение вирусной нагрузки методом ПЦР показало, что монотерапия Виусидом в течение 12 нед практически на нее не влияет, как и у больных, находящихся на базисной терапии. Зарегистрировано ее незначительное снижение у 6 больных (50%) до разведения 1 : 1000 (4+) от исходного уровня 1 : 10000 (5+). В то же время при применении Фосфоглива к концу 12 нед лечения выявлено ее снижение до разведения 1 : 100 (3+) у 67% больных (8 пациентов), а у 16,5% (2 пациента) РНК HCV в крови перестала определяться. У 2 человек (16,5%) титр РНК HCV остался на исходных цифрах (рис. 2). Следовательно, у большинства пациентов была достигнута первичная ремиссия.
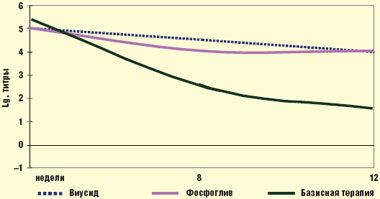
|
| Рис. 2. Динамика РНК вируса гепатита С у больного ХГС (ПЦР) |
Однако при отмене Фосфоглива через 6–8 нед уровень вирусной РНК вновь повышался, повышались и уровни ферментов — до 1,5–2 норм. Возможно, это связано с непродолжительным (12 нед) курсом лечения. Для достижения стойкой ремиссии сроки лечения должны быть продлены (по аналогии с применением ИФН) — возможно, до года и более. Для усиления противовирусной эффективности лечения следует добавлять к терапии аналоги нуклеозидов [21].
Таким образом, применение препаратов ГК эффективно у больных ХГС, что выражается в достижении первичной ремиссии.
Наряду с более быстрым исчезновением симптомов интоксикации на фоне лечения препаратами, содержащими в своем составе ГК, у больных быстрее нормализуются ферменты (АЛТ).
Отечественный препарат Фосфоглив снижает уровень вирусной нагрузки у больных ХГС, что подтверждается при определении РНК методом ПЦР.
Литература
- Kamal S. M., Fehr J., Roesler B., Peters T., Rasenack. Peginterferon alone or with ribavirin enhances HCV-specific CD4 T-helper 1 responses in patients with chronic hepatitis C // Gastroenterology, 2002; 123(4): 1070–83.
- Pockros S., Heathcote E. J., Shiffman M. L. et al. Efficacy of pegylated (40 kDa) interferon — alpha 2a (PEGASYSTM) in randomized trials of patients with chronic hepatitis C with and without cirrhosis: correlations of virologic responses with baseline liver histology and genotype. Hepatology, 2000; 32 (suppl): 442A.
- Ершов Ф. И., Касъянова Н. В. Новые лекарственные средства в терапии вирусных гепатитов // Инфекции и антимикробная терапия. 2001. Т. 3. № 1. С. 17–24.
- Никитин И. Г., Сторожаков Г. И. Хронический гепатит С: актуальные вопросы диагностики и лечения // Российский государственный медицинский университет. Клинические перспективы в гастроэнтерологии, гепатологии. 2001. № 3 С. 7–11.
- Botarelli P., Brunetto M. R., Minutello M. A. et al. T-lymphocyte response to hepatitis C in different clinical courses of infection // Gastroenterology. 1993; 104: 58–67.
- Kroes B. H., Beukelman C. J., van den Berg A. J., Wolbink G.J., van Dijk H., Labadie R. P. Inhibition of human complement by beta-glycyrrhetinic acid // In: Immunology. 1997; 90(1): 115–20.
- Yang G., Yu Y. Immunopotentiating effect of traditional drugs-ginsenoside and glycyrrhiza polysaccharide // In: Proc. Chin. Acad. Med. Sci. Peking, Union Med. Coll 1990; 5(4): 188–93.
- Shibata S. A drug over the millenia: pharmacognosy, chemistry, and pharmacology of licorice // Yakugaku Zasshi. 2000; 120(10): 849–62.
- Yoshicava M., Matsui Y., Kavamoto H. et al. Effects of glycyrrhisin on immune-mediated cytotoxicity // J. Gastroenterol. Hepatol. 1997; 12(3): 243–48.
- Arase Y. et al. The long term efficacy of glycyrrhizin in chronic hepatitis C patients // Cancer. 1997; 79: 1494–1500.
- Miyaji C., Miyakawa R., Watanabe H., Kawamura H., Abo T. Mechanisms underlying the activation of cytotoxic function mediated by hepatic lymphocytes following the administration of glycyrrhizin // Int. Immunopharmacol. 2002; 2(8): 1079–86.
- Okamoto Toshihiro, Kajino Kazunori, Hino Okio. Hepatoprotective Drugs for the Treatment of Virus-Induced Chronic Hepatitis: From Hypercarcinogenic State to Hypocarcinogenic State. // The Japanese Journal of Pharmacology. 2001; 87(3): 177–180.
- Acharya S. K., Dasarathy S., Tandon A., Joshi Y. K., Tandon B. N. A preliminary open trial on interferon stimulator (SNMC) derived from Glycyrrhiza glabra in the treatment of subacute hepatic failure // Indian. J. Med. Res. 1993; 98: 69–74.
- Tsubota A., Kumada H., Arase Y. et al. Combined ursodeoxycholic acid and glycyrrhizin Therapy for chronic hepatitis C virus infection: a randomizeed controlled trial in 170 patients // Eur. J. Gastroenterol Hepatol, 1999; 11.
- Арчаков А. И. Фосфоглив — новый отечественный гепатопротектор. Актуальные вопросы клинической медицины. М., 2001. С. 60–68.
- Fujisawa K. Interferon therapy in hepatitis C virus (HCV) induced chronic hepatitis: clinical significance of pretreatment with glycyrhizine // Trop. Gastroenterol. 1991; 12(4): 176.
- Abe F. Effectiveness of interferon, glycyrrhizin combination therapy in patients with chronic hepatitis // C. Nippon. Rinsho. 1994; 52(7): 1817–1822.
- Van Rossum T. G.; Vulto A. G.; de Man R. A.; Brouwer J. T.; Schalm S. W. Review article: glycyrrhizin as a potential treatment for chronic hepatitis C. // Aliment. Pharmacol. Ther. (England). 1998; 12(3): 199–205.
- Ипатова О. М. Фосфоглив: механизм действия и применение в клинике. М.: ГУ НИИ Биомедхим. РАМН, 2005. 318 с.
- Учайкин В. Ф., Лучшев В. Жаров С. Н. и др. Новый отечественный фосфолипидный препарат Фосфоглив как эффективное средство при лечении больных острыми вирусными гепатитами // Клин. мед. 2000. № 5. С. 39–42.
- Учайкин В. Ф., Арчаков А. И., Ипатова О. М. и др. Фосфоглив. Лечение и защита печени. Пособие для врачей. М.: ГУ НИИ БМХ РАМН, 2004.
С. Н. Жаров, доктор медицинских наук, профессор
РГМУ, Москва
