Респираторные фторхинолоны – расширение терапевтических возможностей в лечении респираторных инфекций
Респираторные инфекции нижних отделов дыхательных путей — пневмония и обострения хронического бронхита — являются одной из самых частых причин обращения за врачебной помощью и назначения антибиотиков. Выбирая антимикробный препарат, врач исходит из ряда критериев. К наиболее важным из них относятся эффективность и безопасность. Эффективность определяется активностью антибиотика в отношении наиболее распространенных возбудителей инфекций нижних отделов респираторного тракта. Среди возбудителей пневмонии наиболее часто встречаются пневмококки, гемофильная палочка, атипичные возбудители — хламидии и микоплазма, а при тяжелом течении — легионелла. У пожилых и стариков, больных сахарным диабетом, хронической обструктивной болезнью легких (ХОБЛ), с нарушенной функцией почек, злоупотребляющих алкоголем возрастает частота таких возбудителей, как клебсиеллы и стафилококки.
Этиология внебольничных пневмоний:
- Streptococcus (Str.) pneumoniae - 20-60%;
- Mycoplasma pneumoniae - 5-50%;
- Сhlamidia pneumoniae - 5-15%;
- Haemophilus (H.) influenzae - 3-10%;
- Бактерии семейства Enterobacteriaceae:
Klebsiella (K.) pneumoniae, Escherichia (E.) coli - 3-10%; - Staphylococcus (S.) aureus - 3-10%;
- Другие (S. pyogenes, Legionella pneumoniae).
Среди этиологических факторов при инфекционных обострениях ХОБЛ доминируют пневмококки и грамотрицательные возбудители: гемофильная палочка, моракселла катаралис. Больные ХОБЛ после стационарного лечения могут быть инфицированы госпитальной микрофлорой (клебсиелла, стафилококки, синегнойная палочка), резистентной к широко применяемым антибактериальным препаратам.
Перечислим наиболее вероятных возбудителей для определенных групп больных:
- старше 65 лет, без сопутствующих заболеваний: H. influenzae, Str. рneumoniae, Moraxella catarrhalis;
- от 65 лет и старше и/или с сопутствующими заболеваниями или обострениями > 2 раз в год: H. influenzae, Str. pneumoniae, K. pneumoniae, E. сoli;
- пациенты с бронхоэктазами, тяжелым течением ХОБЛ: K. рneumoniae, E. сoli, S. aureus, H. influenzae, Pseudomonas (P.) aeruginosa.
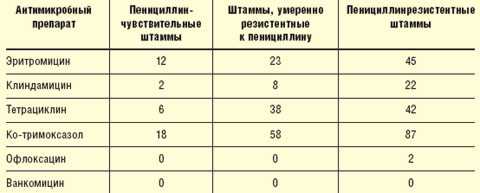
В последние годы наблюдается рост резистентности возбудителей респираторных инфекций. Внушает тревогу прежде всего устойчивость пневмококков к пенициллину, при этом штаммы, устойчивые к пенициллину, приобретают устойчивость и к макролидам, ко-тримоксазолу, тетрациклину, фторхинолонам (табл. 1).
|
|
Таблица 1 Перекрестная устойчивость пенициллинустойчивых пневмококков к другим антибактериальным препаратам, % (B. Murray, 1997) |
При этом от 20 до 40% штаммов гемофильной палочки продуцируют β-лактамазы, что делает их устойчивыми к действию аминопенициллинов. Следует отметить, что распространенность антибиотикорезистентности в разных странах и в разных регионах различаются. В России, по данным исследования «Пегас-1», умеренно резистентные и резистентные к пенициллину штаммы пневмококков составили 11% (Л. С. Страчунский, 2001). По данным того же исследования, резистентность гемофильной палочки к аминопенициллинам в России не представляет значительной проблемы. В то же время исследования, проведенные В. С. Сидоренко и соавт. (2001), показали, что в Москве резистентность пневмококков значительно выше — до 24%. Это еще раз подтверждает важность проведения локального мониторинга чувствительности возбудителей респираторных инфекций и формирования регионарных формулярных списков.
β-лактамные антибиотики (пенициллины, цефалоспорины) малоактивны в отношении штаммов пневмококков, резистентных к пенициллину, и не действуют на атипичных возбудителей. Значение макролидов при лечении респираторных инфекций снижается как ввиду роста резистентности пневмококков, так и недостаточной активности этих антибиотиков в отношении гемофильной палочки и отсутствия действия на микроорганизмы грамотрицательных возбудителей семейства Enterobacteriaceae. Классические фторхинолоны обладают относительно невысокой активностью в отношении пневмококков. Таким образом, рост резистентности возбудителей, увеличение ассоциаций возбудителей, особенно у больных с тяжелым течением заболевания и сопутствующей патологией (Л. А. Алексанян, 1999; А. А. Чибикова, 2005), потребовали расширения перечня препаратов для терапии респираторных инфекций.
«Новые» фторхинолоны относятся именно к таким препаратам. В чем же их отличие от «старых» фторхинолонов?
В настоящее время фторхинолоны делятся на четыре группы (классификация German Paul Ehrlich, 1998).
- Фторхинолоны, активные в отношении грамотрицательных возбудителей, с ограниченными показаниями к применению, в основном при мочевых инфекциях.
- "Классические" фторхинолоны, с широкими показаниями к применению, активные в отношении грамотрицательных, атипичных возбудителей, метициллинчувствительных стафилококков, но обладающие слабой активностью в отношении пневмококков (ципрофлоксацин, офлоксацин).
- "Новые" фторхинолоны с повышенной активностью в отношении пневмококков и атипичных возбудителей и с сохраненной активностью в отношении грамотрицательных возбудителей (левофлоксацин, спарфлоксацин).
- "Новые" фторхинолоны с повышенной активностью в отношении пневмококков и атипичных возбудителей, активностью в отношении грамотрицательных микроорганизмов и умеренной активностью в отношении анаэробных возбудителей (моксифлоксацин, гатифлоксацин).
Фторхинолоны III и IV поколений, сохраняя активность в отношении грамотрицательных возбудителей, более активны в отношении грамположительных кокков и атипичных возбудителей. In vitro они проявляют активность против метициллинрезистентных стафилококков. В связи с высокой активностью в отношении возбудителей респираторной инфекции они получили название «респираторные» фторхинолоны. В отношении P. aeruginosa они менее активны, чем ципрофлоксацин. Возбудители, устойчивые к фторхинолонам II поколения, могут быть чувствительны к фторхинолонам III–IV поколений. Фторхинолоны IV поколения умеренно активны в отношении анаэробов.
Фторхинолоны обладают быстрым бактерицидным эффектом, нарушая синтез дезоксирибонуклеиновой кислоты (ДНК) микробной клеткой путем ингибирования ферментов ДНК-гиразы и топоизомеразы IV, при этом образование ДНК в клетках организма человека не подавляется. Ингибирование функции топоизомераз приводит к необратимым изменениям в микробной клетке и ее гибели.
Фторхинолоны обладают умеренно выраженным постантибиотическим действием, под которым понимают стойкое подавление роста бактерий после ограниченного воздействия на него антимикробного препарата, при этом длительность постантибиотического эффекта зависит от вида микроорганизма и дозы [5]. Резистентность микроорганизмов к фторхинолонам развивается медленно по типу хромосомной и связана с мутациями по генам, кодирующим ДНК-гиразу или топоизомеразу IV. Уровень резистентности бывает более высоким при многоступенчатых мутациях. При этом резистентность развивается только к хинолонам. Новые фторхинолоны гораздо меньше способствуют селекции резистентных штаммов, так как чем больше активность фторхинолона по отношению к обоим ферментам, тем ниже уровень резистентности, который зависит от мутации в генах, кодирующих один фермент [6].
Эффективность антибиотика зависит также и от его фармакокинетических параметров. Всем фторхинолонам свойственны высокая биодоступность при приеме внутрь, большой объем распределения, низкое связывание с сывороточными белками, хорошее проникновение в органы, ткани и клетки организма человека, длительная циркуляция в организме, элиминация почечными и внепочечными механизмами. Биодоступность новых фторхинолонов близка к 100%; пища замедляет, но не снижает их всасываемость. Максимальная концентрация в крови достигается через 1–3 ч после приема. Они имеют большой объем распределения, создают высокие концентрации в тканях и жидкостях организма, проникают внутрь клеток, в полиморфноядерные нейтрофилы, макрофаги, альвеолярные макрофаги, где их концентрации в 2–12 раз превышают внеклеточные концентрации [7]. Респираторные фторхинолоны достигают высоких концентраций в бронхиальном секрете, что является предпосылкой для эрадикации внеклеточно расположенных возбудителей, а высокие внутриклеточные концентрации важны при пневмонии, вызванной атипичными возбудителями; они связываются с белками плазмы на 20–40%. Фторхинолоны проходят через плаценту, проникают в грудное молоко.
Препараты мало подвержены печеночному метаболизму, период полувыведения колеблется от 3–6 ч (левофлоксацин) до 10–12 ч (моксифлоксацин), что позволяет назначать их 1–2 раза в сутки. Выводятся через почки и кишечник, при этом почечная элиминация преобладает у левофлоксацина, и при нарушении функции почек период полувыведения значительно удлиняется. При тяжелой почечной недостаточности требуется коррекция доз всех фторхинолонов. При гемодиализе фторхинолоны удаляются в малой степени. С возрастом фармакокинетические параметры фторхинолонов меняются мало, поэтому коррекции доз у пациентов старших возрастных групп не требуется. В то же время у этих пациентов может быть снижена функция почек, что может привести к повышению концентрации антибиотика в крови [8].
Для фторхинолонов предиктором эффективности является отношение площади под фармакокинетической кривой к минимальной подавляющей концентрации (МПК). При лечении пневмококковой инфекции этот коэффициент должен быть более 30, а при грамотрицательных возбудителях — более 100 [9]. Этот коэффициент 30–44 — для левофлоксацина, значительно выше — для моксифлоксацина и чуть более 10 — при приеме максимальной суточной дозы ципрофлоксацина (табл. 2). Эти данные еще раз подтверждают, что ципрофлоксацин малоэффективен при инфекциях, вызванных пневмококками, и не может быть препаратом первого ряда при респираторных амбулаторных инфекциях.

|
|
Таблица 2 Отношение площади под кривой «концентрация — время (AUC)» к минимальной подавляющей концентрации для фторхинолонов (AUC/МПК90 для фторхинолонов в отношении пневмококков) |
Безопасность антибиотикотерапии определяется частотой и тяжестью развития нежелательных действий препарата и риском развития нежелательных лекарственных и диетических взаимодействий. При применении респираторных фторхинолонов нежелательные эффекты развиваются нечасто. В большинстве случаев это проявления диспепсии (тошнота, рвота, диарея); могут отмечаться головная боль, головокружения, нарушения сна. У пожилых и старых людей, особенно на фоне приема системных глюкокортикостероидов, существует риск разрыва сухожилий. Может отмечаться преходящее повышение активности печеночных ферментов. В единичных случаях описано развитие анафилактического шока, судорожного синдрома. Риск развития артропатий ограничивает их применение у беременных и кормящих, а также у детей.
Антацидные препараты, содержащие алюминий и магний, снижают всасывание фторхинолонов из желудочно-кишечного тракта, поэтому перерыв во времени между приемом антацида и антибиотика должен составлять не менее 2 ч. Не отмечено взаимодействия с ферментной системой цитохрома Р450 [9].
Эффективность антибиотикотерапии во многом зависит от соблюдения пациентом режима терапии, от того, насколько он следует рекомендациям врача. Сложность режима приема препарата (связь с приемом пищи, частота приема, количество препаратов), нежелательные действия (в том числе легкие, которые, по мнению врача, не требуют отмены препарата) могут спровоцировать больного на прекращение лечения. Как показали результаты фармакоэпидемиологического исследования, примерно 50% взрослых прекращали антибактериальную терапию преждевременно, а более 10% не следовали рекомендуемому режиму дозирования. Среди родителей 18,7% заканчивали антибактериальную терапию у детей преждевременно (не придерживались рекомендуемого врачом курса). Таким образом, результаты проведенного исследования показали, что взрослое население характеризируется неудовлетворительной комплаентностью в отношении рекомендуемой длительности курса антибактериальной терапии [10]. При проведении исследования по оценке сравнительной эффективности коротких (5-дневных) курсов левофлоксацина и 7-дневных было показано, что эффективность первых курсов не отличается от последних: при обоих режимах лечения отмечалась равная клиническая и микробиологическая эффективность [11]. С этих позиций респираторные фторхинолоны, которые можно принимать однократно в сутки, независимо от приема пищи и короткими курсами, имеют преимущества перед многими другими антибактериальными препаратами и их назначение повышает комплаентность пациентов.
Наличие форм для парентерального и перорального введения повышают удобство использования препаратов и делают возможным их использование в режиме ступенчатой терапии.
Клиническая, бактериологическая эффективность и безопасность респираторных фторхинолонов была оценена во многих многоцентровых клинических исследованиях. Так, по данным метаанализа пяти клинических исследований, прием моксифлоксацина в дозе 400 мг 1 раз в сутки при респираторных инфекциях по клинической эффективности не отличался от амоксициллина в дозе 1000 мг 3 раза в сутки и кларитромицина в дозе 500 мг 2 раза в сутки. Бактериологическая эффективность моксифлоксацина была выше и составила 94%. При использовании левофлоксацина при лечении пациентов с пневмонией препарат применяли в суточной дозе 500 мг. В исследование включили 68 больных; у 26 была пневмония тяжелого течения — у них левофлоксацин применяли в режиме ступенчатой терапии. Клиническая и бактериологическая эффективность препарата составила 100%. Только в одном случае (1,4%) потребовалась его отмена из-за преходящих нарушений психики [12]. В исследовании C. Fogarty et al. (1999) эффективность и безопасность терапии моксифлоксацином в дозе 400 мг в сутки в течение 10 дней сравнивали с эффективностью и безопасностью кларитромицина в дозе 500 мг в сутки в течение 10 дней. В исследование были включены 382 пациента с внебольничной пневмонией. Оба препарата оказались сопоставимы как по эффективности, так и по частоте развития нежелательных действий. Эффективность лечения составила 95%. В исследование по сравнению эффективности моксифлоксацина и кларитромицина у больных ХОБЛ были включены 750 пациентов (R. Wilson et al., 1999). Пациенты получали моксифлоксацин в дозе 400 мг/сут в течение 5 дней или кларитромицин в дозе 500 мг 2 раза в сутки в течение 7 дней. Клиническое выздоровление отмечалось у 89% пациентов, получавших моксифлоксацин, и у 88% пациентов, принимавших кларитромицин. Через месяц после окончания курса терапии клиническая эффективность подтверждена у 89% пациентов обеих групп. При этом бактериологическая эффективность моксифлоксацина была достоверно выше: 77,4 и 62,3% соответственно. Российские авторы сравнивали эффективность лечения обострения хронического бронхита левофлоксацином в дозе 500 мг/сут в течение 7 дней и цефуроксим аксетилом в дозе 250 мг 2 раза в сутки в течение 10 дней. Клиническая эффективность препаратов не отличалась и составила 92% в обеих группах, тогда как бактериологическая эффективность была выше в группе принимавших левофлоксацин и составила 94% против 87% в группе лечения цефуроксим аксетилом [14].
В заключение следует отметить, что респираторные фторхинолоны высокоактивны в отношении наиболее распространенных возбудителей пневмонии и обострения хронического бронхита, в том числе штаммов, устойчивых к β-лактамам, макролидам. Препараты обладают высокой биодоступностью при приеме внутрь, быстро всасываются, создают высокие концентрации в легочной ткани, бронхолегочном секрете, в клетках организма человека. Они обладают длительным периодом полувыведения, что позволяет принимать их 1–2 раза в сутки, выпускаются в виде форм для парентерального и перорального приема, что дает возможность использовать их в режиме ступенчатой терапии. Эффективность коротких 5-дневных курсов сопоставима с эффективностью более длительных курсов антибактериальной терапии. Препараты хорошо переносятся, обладают минимальным количеством нежелательных лекарственных и диетических взаимодействий.
По вопросам литературы обращайтесь в редакцию.
Е. А. Прохорович, доктор медицинских наук, профессор
МГМСУ, Москва
