Терапия препаратами магния при первичном пролапсе митрального клапана
Нормальный уровень магния в организме человека признан основополагающей константой, контролирующей здоровье человека [2, 7, 8]. В настоящее время среди возможных патогенетических механизмов дисплазии соединительной ткани (ДСТ) многие исследователи указывают на хронический дефицит ионов магния, что ведет к нарушению формирования соединительнотканных структур, обусловливает хаотичность расположения волокон коллагена — основной морфологический признак ДСТ [5, 7, 9, 10].
Сведения о распространенности дефицита магния (норма магния в сыворотке крови: 1,0–1,15 ммоль/л) варьируются в широких пределах в зависимости от исследованной популяции, критериев диагностики и использованных методов исследования. По данным исследований, проведенных в России с участием пациентов с идиопатическим пролапсом митрального клапана (ПМК), уменьшение содержания магния в волосах выявлено в 72,0% случаев [5]. В схемы комплексного ведения пациентов с первичным ПМК прочно вошли препараты магния [5].
С целью сравнения эффективности применения у пациентов с идиопатическим ПМК препаратов Магнерот и Магне В6 мы провели простое сравнительное открытое проспективное исследование.
Критериями включения служили:
- ранее диагностированный первичный ПМК в возрасте от 16 до 35 лет;
- понимание пациентами сути предстоящего исследования;
- возможность проведения монотерапии препаратом магния и соблюдения двухнедельного периода вымывания перед проведением исследования в случае, если больной получал медикаментозную терапию;
- добровольное информированное согласие на участие в исследовании.
Критериями исключения были:
- наличие врожденного или приобретенного порока сердца, подтвержденного данными ЭхоКГ;
- наличие черепно-мозговой травмы в анамнезе;
- сердечно-сосудистые заболевания;
- острые заболевания в течение одного месяца до исследования;
- противопоказания к применению препаратов магния;
- побочные эффекты терапии, требующие отмены препарата;
- несоблюдение больным графика лечения и обследования;
- нежелание пациента продолжать участие в исследовании.
В соответствии с критериями включения и исключения (табл. 1), в исследование были включены 90 пациентов с идиопатическим ПМК (45 мужчин и 45 женщин) в возрасте 23,3 ± 5,2 года. У 52 пациентов функция митрального клапана была нарушена в виде наличия митральной регургитации различной степени выраженности (39% — регургитация 1-й степени, 39% — 2-й степени, 22% — 3-й степени); у 32 больных функция митрального клапана была сохранена; в 64% случаев выявлялась миксоматозная дегенерация митрального клапана. Кроме того, отмечены: в 14% случаев — расширение аорты, в 20% — пролапс трикуспидального клапана, в 87% — аномально расположенные хорды, в 56% — удлинение хорд митрального клапана. Все пациенты имели те или иные фенотипические признаки ДСТ: у всех выявлен астенический тип конституции, у 78% наблюдались деформации грудной клетки или позвоночника, у 26% — другие локомоторные проявления ДСТ (синдром гипермобильности суставов, плоскостопие, искривление нижних конечностей), у 34% — птозы внутренних органов, у 72% — дефицит массы тела. В качестве группы контроля были обследованы 30 практически здоровых добровольцев (15 мужчин и 15 женщин, средний возраст — 22,3 ± 3,5 года), соответствующих по полу и возрасту.
Всем пациентам было проведено общеклиническое обследование, эхокардиография, суточное мониторирование ЭКГ по Холтеру (Холтер-ЭКГ), велоэргометрия (ВЭМ), а также определение уровня магния в слюне и сыворотке. Исходный вегетативный тонус оценивали на основании клинических тестов (А. М. Вейн, 1998). Для выявления и оценки невротических нарушений использовался опросник, разработанный Д. М. Менделевичем и К. К. Яхиным [3]. Статистическая обработка результатов проводилась с использованием пакета программ SPSS for Windows.
Результаты. Оценка субъективного статуса пациентов, проведенная до начала медикаментозной терапии, продемонстрировала преобладание жалоб со стороны сердечно-сосудистой системы — 89%. Далее по частоте отмечены жалобы астенического характера (слабость, вялость, легкая утомляемость, снижение работоспособности, апатия): они регистрировались у 80% пациентов.
При проведении ЭКГ и Холтер-ЭКГ были выявлены случаи манифестных и латентных нарушений ритма и проводимости сердца. Проведение Холтер-ЭКГ в большинстве случаев было более информативно в диагностике нарушений ритма пациентов с ПМК, что диктует необходимость включения этого метода диагностики в программу обследования пациентов с ДСТ. По данным Холтер-ЭКГ, у пациентов с ПМК фиксировались суточные колебания сердечного ритма от 39-59 до 109-182 уд/мин. У 42% (38 пациентов) выявлен синдром ранней реполяризации желудочков, у 68 человек — нарушения процессов реполяризации различной степени выраженности, у 24 больных — удлинение интервала QT в сравнении с должной величиной.
По данным анкетирования, у 76 (84%) пациентов была выявлена вегетососудистая дистония, при этом у 54 больных (71%) обнаружена симпатикотония, у 22 (24%) — ваготония, у 14 человек — эутония. Анализ вариабельности сердечного ритма у пациентов с ПМК продемонстрировал достоверно более высокие значения среднесуточных показателей — SDNN, SDNNi, RMSSD с преобладанием активности симпатического отдела (SDANN — 149,4 мс, р = 0,004).
Уровни магниемии у пациентов с ПМК достоверно не отличались от контрольной группы и от нормального содержания магния в сыворотке крови, тогда как исследование концентрации магния в ротовой жидкости документировало дефицит данного макроэлемента у пациентов с ПМК, подтверждая имеющиеся литературные данные (табл. 2)
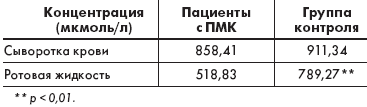
|
| Таблица 2. Содержание магния в сыворотке крови и ротовой жидкости пациентов с ПМК |
При сопоставлении показателей вариабельности сердечного ритма и уровнем магния в ротовой жидкости выявлены прямые корреляционные взаимосвязи: чем ниже содержание магния в биологических средах организма, тем ниже показатели вариабельности сердечного ритма и выше тонус симпатической нервной системы. Возможным объяснением этого явления может быть нарушение активности Na+–K+-АТФ-азы при низкой концентрации ионов магния, что влияет на обратный захват адреналина симпатическими нейронами, и, следовательно, его инактивацию и приводит к гиперсимпатикотонии.
Анализ показателей клинического опросника для выявления и оценки невротических состояний выявил присутствие в психологическом профиле пациентов такого феномена, как невротическая тревога (табл. 3). Кроме того, значения по шкалам астении и вегетативных нарушений превысили уровень показателей нормального диапазона, что отражало формирование психического истощения, обусловленного вегетативной напряженностью, являющейся одним из облигатных признаков ДСТ [4].
После проведенного обследования пациенты с ПМК были распределены методом последовательного включения на две группы, сопоставимые по полу и возрасту. Пациентам группы I (45 человек) назначался Магнерот по схеме: 2 таблетки 3 раза в день первые 7 дней, затем по 1 таблетке 3 раза в день в течение 8 нед. В группе II (45 человек) назначался Магне В6: 2 таблетки 3 раза в день в течение 8 нед.
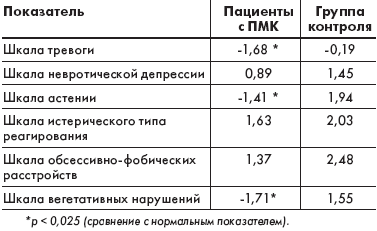
|
| Таблица 3. Величины диагностических коэффициентов по шкалам невротических расстройств |
Повторное обследование пациентов проводилось после завершения курса лечения. Уровень магния в ротовой жидкости достоверно повысился в обеих группах (0,903 ммоль/л, р < 0,05 и 0,897 ммоль/л, p < 0,05 соответственно в группах I и II), что подтверждает эффективность второго поколения элементорганических препаратов магния как средств, корректирующих дефицит этого макроэлемента. На фоне подтвержденного повышения уровня магния в обеих группах пациентов отмечена отчетливая положительная субъективная динамика, которая сочеталась со снижением уровня невротизации по шкалам невротической тревоги, астении и вегетативных нарушений.
Улучшение самочувствия пациентов на фоне лечения косвенно подтверждает наличие взаимосвязи между уровнем магния в организме и жалобами больных. Эффективность препаратов магния в данном случае может быть обусловлена наличием седативного и вегетотропного эффекта, которые объясняются торможением процессов возбуждения в коре головного мозга, а также влиянием на высшие вегетативные центры. Положительная динамика астенического и тревожного синдромов была подтверждена и при оценке показателей опросника. Указанные изменения были однотипны в обеих группах.
При оценке изменений показателей Холтер-ЭКГ после терапии по сравнению с исходным уровнем, выявлено достоверное уменьшение средней ЧСС в I и II группах пациентов (-9,5, р = 0,019; -7,2, p = 0,02), максимальной ЧСС (-10,6, p = 0,043; -10,2, p = 0,05) в обеих группах. Позитивная динамика ЭКГ-изменений проявилась в снижении частоты встречаемости нарушений процессов реполяризации I степени (McNemar 14,27; р = 0,0002) и II степени (McNemar 10,09; р = 0,002). После проведенного лечения отмечена статистически достоверная нормализация показателей интервала QT и его дисперсии на фоне восстановления уровня магния (табл. 4). Однако следует подчеркнуть результаты первой группы как более предпочтительные исходя из статистической значимости различий.
Анализ эктопической активности по данным Холтер-ЭКГ выявил положительную динамику — исчезновение нарушений ритма высоких градаций в обеих группах пациентов с ПМК.
По данным суточного мониторирования ЭКГ, уменьшение количества желудочковых экстрасистол в группах I и II отмечено у 20% пациентов, у 56% группы I и у 41% группы II (р = 0,158) они исчезли, у 9% пациентов группы I и у 7% группы II (р = 0,727) вместо политопных желудочковых экстрасистол регистрировались редкие монотопные экстрасистолы. Антиаритмическая активность препаратов магния в данном случае связана прежде всего с тем, что магний, входящий в его состав, является естественным антагонистом кальция, обладает мембраностабилизирующим свойством, присущим антиаритмическим препаратам I класса, способен препятствовать потере калия клеткой, уменьшать дисперсию длины интервала QT на ЭКГ, а также ингибировать симпатические влияния на сердце [1].
Прием препаратов магния лицами с ПМК привел к заметному изменению вегетативного обеспечения различных форм деятельности, что определяется при анализе вариабельности сердечного ритма; уменьшение симпатического влияния вегетативной нервной системы и усиление парасимпатической активности в дневное время привело к уменьшению вегетативной дисрегуляции сердечного ритма.
Препараты магния восстанавливают вагусную защиту сердца за счет увеличения RMSSD днем и снижения в ночные часы; тонус симпатического отдела, отраженный показателем SDANN, изменился незначительно — отмечено его снижение днем и увеличение в ночные часы.
Таким образом, можно предположить, что гипомагниемия может быть частично ответственна за нарушение вегетативного баланса. Восполнение дефицита магния у пациентов с ПМК уменьшает вегетативную дисрегуляцию, устанавливает гомеостаз в вегетативной нервной системе, повышая парасимпатическую составляющую. Механизм действия препаратов магния в данной ситуации, по всей видимости, связан с улучшением функционального состояния миокарда за счет влияния на адренергические и холинергические рецепторы, а также с восполнением дефицита магния у данной категории лиц [1].
Курс терапии препаратами магния не оказал достоверного влияния на показатели кардиогемодинамики, что, возможно, связано с небольшим периодом наблюдения.
В группе пациентов, получавших оротат магния (Магнерот), наблюдалось увеличение массы тела и индекса массы тела (масса тела 53,8 и 57,56 кг, индекс массы тела 17,57 и 17,91 кг/м2 соответственно до и после лечения (p > 0,05)). Изменения массы тела были отмечены у 42% пациентов этой группы (р = 0,091). Наибольшая прибавка составила 3 кг к завершению курса лечения; вместе с тем у большинства пациентов данной группы показатели индекса массы тела оставались ниже возрастной нормы. При этом следует отметить, что все 19 пациентов, отмечавших положительную динамику массы тела, активно интересовались возможностью продлить курс лечения Магнеротом. Вопрос, связан ли описанный эффект с особенностью препарата — наличием в составе оротовой кислоты — требует уточнения.
В обеих группах все пациенты завершили полный курс лечения препаратом. Курсовая доза магния, полученная в первой группе Магнерот, составила 6 888 мг, во второй группе (Магне В6) — 16 128 мг. Препараты магния хорошо переносились больными, лишь у двух человек группы I (4%) были жалобы на головокружение и нарушение стула при приеме 6 таблеток Магнерота в день, которые исчезли через 2 дня после снижении дозы препарата наполовину. Других отступлений от протокола лечения не наблюдалось.
Выводы
- Применение препаратов магния у пациентов с ПМК патогенетически обосновано выявляемым дефицитом тканевого пула данного макроэлемента.
- Курсовое назначение препаратов магния приводит к улучшению субъективного самочувствия. Магнерот устраняет вегетативную дисфункцию также хорошо, как апробированный в практике кардиологов и неврологов Магне В6.
- Положительная динамика электрофизиологических показателей сердечной деятельности, уменьшение частоты эпизодов желудочковых нарушений ритма и наджелудочковой экстрасистолии наблюдается в обеих группах. Однако использование препарата Магнерот более предпочтительно, о чем свидетельствуют данные статистического анализа.
- Лекарственные средства второго поколения магнийорганических препаратов (Магнерот, Магне В6) демонстрируют эффективность в качестве корректоров магниевого дефицита. Следует отметить, что в первой группе курсовая доза магния была на 9 900 мг меньше, а приверженность к терапии и полученные результаты оказались выше.
- С учетом метаболической активности оротовой кислоты [2], входящей в состав препарата Магнерот, и полученной динамики массы тела у 19 пациентов группы I (не достигшей статистически значимого уровня) требуется дальнейшее исследование в плане уточнения возможного влияния препарата на показатели трофологического статуса пациентов.
Литература
- Городецкий В. В. Препараты магния в медицинской практике. Малая энциклопедия магния / В. В. Городецкий, О. Б. Талибов. М.: Медпрактика, 2003. 44 с.
- Громова О. А. Магний и пиридоксин: основы знаний. Новые технологии диагностики и коррекции дефицита магния / О. А. Громова. Обучающие программы ЮНЕСКО. М.: РСЦ Институт микроэлементов, ЮНЕСКО, 2006. 176 с.
- Менделевич В. Д. Клиническая медицинская психология: Практическое руководство / В. Д. Менделевич. М.: Медпресс, 1998. 542 с.
- Нечаева Г. И. Кардио-гемодинамические синдромы при дисплазии соединительной ткани (клиника, диагностика, прогноз): автореф. дис. … д-ра мед. наук / Г. И. Нечаева. Томск, 1994. 37 с.
- Результаты применения магниевой соли оротовой кислоты «Магнерот» при лечении больных с идиопатическим пролапсом митрального клапана / О. Б. Степура, О. О. Мельник, А. Б. Шехтер и др. // Российские медицинские вести. 1999. № 2. С. 64–69.
- Dreosti E. Magnesium status and health / Dreosti E. // Nutr. Rev. 1995; 53: 23–7.
- Durlach J. Primary mitral valve prolapse: a clinical form of primary magnesium deficit / J. Durlach // Magnes. Res. 1994; 7: 339–340.
- Durlach J. Le magnesium en biologie et an medicine / Durlach J., Bara M. // 2nd edition. Cachan (France): Edition Medicales Internationales; 2000.
- Idiopathic magnesium deficiency in mitral valve prolapse / L. Cohen, H. Bittermann, E. Grenadier et al // Amer. J. Сardiol. 1986; 57 (6): 486–487.
- Is magnesium deficit in lymphocytes a part of the mitral valve prolapse syndrome?/ Kitliewski M., Stepniewski M., Nessler J. et al. // Magnes. Res. 2004; 17(1): 39–45.
- Schimatchek H. F. Prevalence of hypomagnesemia in an unselected German population of 16,000 individuals / Schimatchek H. f., Rempis R. // Magnes. Res. 2001; 14: 283–90.
Г. И. Нечаева, доктор медицинских наук, профессор
И. В. Друк, кандидат медицинских наук
О. В. Тихонова, кандидат медицинских наук
С. Л. Морозов
Омская ГМА, Омск
Врезки:
