Современные позиции бариатрической медицины
Есть тысяча причин, из-за которых эпидемия ожирения выходит из-под контроля.
Но одна заключается в том, что никто не хочет говорить об этом
Д-р Р. Вашингтон, председатель комиссии по проблеме ожирения
Американской медицинской ассоциации.
Ожирение во всем мире приобретает характер пандемии. Так, по данным статистики ВОЗ, около 30% жителей планеты имеют избыточную массу тела, из них 16,8% составляют женщины и 14,9% — мужчины, а к 2025 г. примерно половина женщин и более 40% мужчин будут страдать ожирением. В России на 2003 г. индекс массы тела (ИМТ) > 29 (ожирение) имели 14 млн женщин и 6 млн мужчин (С. А. Шальнова и соавт., 2005). По данным А. С. Аметова (2004), более 30% больных молодого и среднего возраста имеют повышенный ИМТ и 25% — ожирение, у каждого третьего пациента до 60 лет отмечаются нарушения углеводного обмена, артериальная гипертензия (АГ) и другая соматическая патология (Ю. Б. Белоусов, К. Г. Гуревич, 2003). В 96% случаев речь идет о социально активных пациентах, которые редко обращаются за медицинской помощью (М. Б. Анциферов, 2004).
С ожирением могут быть связаны следующие патологии (Ю. Б. Белоусов, К. Г. Гуревич).
- Заболевания сердечно-сосудистой системы:
— артериальная гипертензия, ИБС;
— гипертрофия левого желудочка, сердечная недостаточность.
- Метаболические заболевания:
— сахарный диабет 2 типа: нарушение толерантности к глюкозе, гиперинсулинемия;
— дислипидемия — усиление образования атерогенных липопротеинов, желчнокаменная болезнь, гиперурикемия, жировая дистрофия печени.
- Нарушения опорно-двигательного аппарата:
— дегенеративные заболевания суставов, артроз коленного сустава.
- Нарушения свертывающей системы крови:
— гиперфибриногенемия, уменьшение концентрации ингибитора плазминогена в плазме крови.
- Нарушение функции респираторной системы:
— ночное апноэ.
- Новообразования:
— увеличение риска возникновения новообразований.
- Сексуальные расстройства:
— снижение либидо, фертильности, нарушения менструального цикла.
Несмотря на существенный прогресс в понимании патогенеза и клиники ожирения, до сих пор идут споры о том, что первично: ведет ли ожирение к развитию «заболеваний-спутников», или сначала возникают соматические патологии, приводящие к ожирению.
В терапевтической практике ожирение часто рассматривают как один из компонентов метаболического синдрома. Метаболический синдром (Internntional Diabetes Federation (IDF), апрель 2005 г.) включает наличие у пациента центрального (абдоминального) ожирения (окружность талии (ОТ) более 94 см для мужчин и более 80 см для женщин) в сочетании с любыми двумя из четырех нижеследующих факторов:
- уровень триглицеридов > 1,7 ммоль/л;
- снижение липопротеидов высокой плотности (ЛПВП) < 1,03 ммоль/л у мужчин и < 1,29 ммоль/л у женщин;
- повышение систолического артериального давления (АД) > 130 и диастолического АД > 85 мм. рт. ст.;
- гликемия натощак > 5,6 ммоль/л или ранее установленный диагноз сахарного диабета 2 типа.
В последние годы в определении метаболического синдрома появились такие составляющие, как синдром поликистозных яичников, гипертрофия левого желудочка, гиперурикемия, гиперфибриногенемия и др. (P. Haffner et al. 1992.). Инсулинорезистентность (ИР) часто выявляется у больных с ожирением, при других заболеваниях или нарушениях, входящих в понятие метаболического синдрома. Так, ИР диагностируют у 58% больных с АГ, у 84% с гипертриглицеридемией, у 42% с гиперхолестеринемией, у 66% с нарушенной толерантностью к глюкозе (НТГ) (E. Borona, S. Kiechl et al., 1998). Частота и выраженность ИР при ожирении возрастают при увеличении общей массы тела, особенно висцеральной жировой ткани. При метаболическом синдроме ИР обнаруживают в 95% случаев, что свидетельствует о ведущей роли ИР в развитии метаболического синдрома и о том, что она служит связующим звеном между ожирением и сахарным диабетом 2 типа.
Виды ожирений
В 1947 г. французским врачом Jean Vague было выделено два типа отложения жира: андроидный и гиноидный. Андроидный (мужской, абдоминальный) тип ожирения характеризуется преимущественным отложением жира в верхней половине туловища, на животе, а также увеличением объема висцерального жира (в сальнике, брыжейке и ретроперитонеальной области). Характерно увеличение диаметра жировых клеток до 20 раз, жировые отложения в них могут занимать около 90% от объема в целом; возрастает и количество адипоцитов (гипертрофия и гиперплазия адипоцитов). Гиноидное ожирение (глютеофеморальное, ягодично-бедренное или «нижнее») характеризуется равномерным распределением жира с преобладанием его в области ягодиц и бедер.
Для количественной оценки массы тела и тяжести ожирения используют ИМТ. Расчет ИМТ (индекс Кетле) осуществляется по формуле: масса тела (кг)/рост (м2). Значения ИМТ напрямую связаны с риском сопутствующих осложнений и смерти. На ожирение указывает ИМТ более 30, на избыточную массу тела — ИМТ от 25 до 29,9, за норму принимают ИМТ от 18,5 до 24,9. В зависимости от величины ИМТ выделяют три степени ожирения (табл.).
Кроме увеличения ИМТ, к высокому риску развития сердечно-сосудистых заболеваний (ССЗ) относится абдоминальное ожирение (АО). Подкожная жировая клетчатка в области живота вместе с висцеральным жиром составляют абдоминальный жир. Площадь висцеральной жировой ткани > 110 см2 и величина ОТ > 88 см у женщин и площадь висцерального жира > 130 см2 и ОТ > 102 см у мужчин свидетельствуют об абдоминальном ожирении. ОТ измеряется в положении стоя, точка измерения находится на середине расстояния между вершиной гребня подвздошной кости и нижним боковым краем ребра. Важен также показатель отношения ОТ к окружности бедер (ОБ) — ОТ/ОБ. ОБ измеряется в положении стоя на уровне лобкового симфиза спереди большого вертела бедренной кости сбоку. Если указанное соотношение у мужчин превышает 0,95, а у женщин — 0,85, уже можно говорить о патологическом отложении жира в абдоминальной области. Для определения количества абдоминально-висцерального жира используют компьютерную или магнитно-резонансную томографию (M. Pouliot et al. 1994.). Большое значение имеет измерение ОТ у лиц с ИМТ от 25 до 34,9 кг/м2; при наличии АО их переводят в группу более высокого риска и назначают медикаментозную терапию.
Генез ожирения
Известно более 50 генов, ответственных за развитие ожирения. Тем не менее основная роль в большой распространенности ожирения отводится факторам внешней среды: увеличение потребления высококалорийной пищи с преобладанием питания в вечернее и ночное время, низкая физическая активность.
Увеличение массы тела связано с нарушением энергетического баланса (М. Г. Бубнова), когда поступление энергии (калорий с пищей) превышает ее расход.
Мышечная работа является очень важным фактором, влияющим на энергообмен. Еще в XVI в. Войцех Очко заметил, что «физическое усилие может заменить любое лекарство, никакое лекарство не заменит физическое усилие».
Пищевое поведение регулируется кратковременными и долговременными механизмами (K. N. Frayn, 2003). Кратковременные механизмы регулируют прием пищи в течение дня, они представлены сигналами насыщения из желудочно-кишечного тракта (ЖКТ) и печени. Долговременный механизм обеспечивает регуляцию массы тела в течение месяцев за счет системы гипоталамуса и различных нейротрансмиттеров и нейропептидов.
Гипоталамус является центральным звеном в регуляции пищевого поведения, а следовательно, и массы тела. Центры «насыщения» (вентромедиальные ядра) и «голода» (вентролатеральные ядра) гипоталамуса поддерживают баланс между потреблением и расходом энергии, тесно сообщаясь с другими отделами центральной нервной системы (ЦНС) — корой больших полушарий, в том числе с корковыми отделами зрительного, вкусового и обонятельного анализаторов, лимбической системой, с центрами регуляции эндокринной системы (М. Г. Бубнова).
В патогенезе ожирения важными индикаторами пищевого поведения являются биогенные амины — серотонин, норадреналин и допамин.
Именно серотонину отводится основная роль в формировании чувства насыщения (Y. Mori, 2001). Серотонин синтезируется в организме человека из незаменимой аминокислоты триптофана. Уровень триптофана повышается при приеме белковой пищи и при катаболизме белков в тканях самого человека, что возможно при потреблении большого количества легкоусвояемых углеводов и резком выбросе инсулина. Патогенез развития ожирения связывают с низким синтезом серотонина, что вызывает уменьшение концентрации его в синаптической щели (S. Park et al., 1999). Избыток серотонина в ЦНС стимулирует ощущение удовольствия, а недостаток приводит к депрессии: по этим причинам больной пытается возместить недостаток серотонина обильным приемом пищи.
Норадреналин (норэпинефрин) является орексигенным нейротрансмиттером, однако на периферии норадреналин действует катаболически, способствуя нормализации энергозатрат. К тому же норадреналин значительно усиливает эффект серотонина в отношении чувства насыщения (М. Г. Бубнова).
Помимо центральной регуляции, на пищевое поведение влияют периферические факторы насыщения — вещества, которые вырабатываются в ЖКТ, печени, поджелудочной железе. Одним из них является холецистокинин (S. C. Wood et al., 2002). Помимо холецистокинина, существует ряд гастроинтестинальных пептидов, также регулирующих чувство насыщения: эндостатин, бонбезин, нейротензин и гастринингибирующий пептид, пептид YY3-36. Эти пептиды вырабатываются адипоцитами ЖКТ, обнаруживаются также в различных структурах мозга, нервных клетках ВНС, в связи с чем их относят к нейропептидам.
К орексигенным пептидам принадлежит грелин, вырабатываемый клетками слизистой оболочки желудка. Максимальный синтез грелина наблюдается перед приемом пищи и в ночное время.
В настоящее время остается открытым вопрос о первичности ИР, или абдоминального ожирения. ИР — это нарушение ответа инсулин-чувствительных тканей на воздействие инсулина. В развитии ИР могут иметь значение мутации генов субстрата инсулинового рецептора (IRS-1 и IRS-2), β3-адренорецепторов, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (глюкозные транспортеры) (В. С. Задионченко). Известно, что инсулин секретируется β-клетками поджелудочной железы в соответствии с количеством принятой пищи. Однако у тучных людей количество базального инсулина, вырабатываемого натощак, а также в период после еды больше, чем у лиц с нормальной массой тела (K. S. Polosky et al., 1988). Долгое время гиперпродукциия инсулина компенсирует ИР, при этом приводит к нарушению действия инсулина на уровне периферических клеток, т.е. развивается ИР.
Особое место в развитии ожирения играет жировая ткань абдоминальной области, так как, в отличие от подкожной, она лучше кровоснабжается и иннервируется, имеет большую плотность β3-адренорецепторов, кортикостероидных, андрогенных рецепторов и меньшую плотность инсулиновых и β2-рецепторов, располагается ближе к портальной системе печени (В. С. Задионченко). Висцеральную жировую ткань в настоящее время рассматривают как эндокринный орган. Кроме веществ, влияющих на липидный обмен, жировая ткань продуцирует эстрогены, цитокины, ангиотензиноген, ингибитор активатора плазминогена-1, липопротеинлипазу, адипсин, адинопектин, интерлейкин-6, фактор некроза опухолей-α (ФНО-α), трансформирующий ростовый фактор В, лептин и др.
Лечение ожирения
Общие положения. Анализ большинства русскоязычных сайтов в Интернете показал, что в отношении коррекции массы тела пользователя в основном ориентируют на прием биологически активных добавок (БАДов), диуретиков, слабительных препаратов, часто не зарегистрированных в РФ и не прошедших серьезных клинических испытаний. Таким образом, в случае применения данных препаратов пациент не застрахован от серьезных побочных воздействий, развития аллергических реакций, нарушений функций ЖКТ, перехода в более тяжелую форму сопутствующих заболеваний и других нежелательных эффектов. Когда речь идет о хирургических методах лечения ожирения, выясняется, что в большинстве клиник не предусмотрена до- и послеоперационная терапия соматической патологии. Поэтому пациентам с ожирением необходима достоверная информация, доступная на всех этапах обращения больного к врачу любого профиля.
Принципы лечения ожирения основаны на рекомендациях Международной группы по ожирению ВОЗ, Шотландской группы по выработке междисциплинарных рекомендаций, Национального института здоровья США и предусматривают:
- пожизненность и систематичность лечения;
- реальность поставленных целей;
- постепенное снижение массы тела;
- поэтапность лечения;
- индивидуальный подход;
- контроль факторов риска и/или сопутствующих заболеваний;
- комплексность терапии.
Уменьшение массы тела на 10% соответственно приводит к 10-процентному снижению общей смертности (H. B. Hubert et al., 1983).
Программа по уменьшению массы тела включает немедикаментозные мероприятия, фармакотерапию и в ряде случаев хирургическую коррекцию.
Немедикаментозные мероприятия (И. Е. Чазова, В. Б. Мычка, 2002) включают следующие позиции:
- диета;
- обучение больных;
- ведение дневника питания;
- изменение пищевых привычек;
- повышение физической активности.
Фармакотерапия ожирения преследует следующие цели:
- достижение эффективного снижения массы тела;
- компенсация метаболических нарушений;
- улучшение переносимости лечения;
- повышение приверженности больных к лечению;
- облегчение соблюдений рекомендаций по изменению образа жизни;
- предотвращение рецидивов заболевания.
Согласно требованиям Food Drug Administration (FDA), препараты для лечения ожирения должны соответствовать следующим критериям:
- открытый механизм действия;
- клиническая эффективность, доказанная в ходе рандомизированных двойных слепых плацебо-контролируемых исследований, проводившихся в течение 1 года, и открытых или двойных слепых исследований, проводившихся в течение 2 лет;
- преходящие, слабые побочные эффекты;
- хорошая переносимость, безопасность;
- отсутствие зависимости;
- положительное воздействие на сопутствующие ожирению нарушения метаболизма и течение ассоциированных заболеваний. Уменьшение массы тела при проведении фармакотерапии должно превышать эффект плацебо не менее чем на 5%.
Показанием к назначению фармакотерапии ожирения служит ИМТ > 30 или ИМТ > 27 с абдоминальным ожирением в сочетании с одним из следующих факторов:
- снижение массы тела менее чем на 5% от исходной в течение 3 мес немедикаментозного лечения;
- длительный анамнез ожирения с большим количеством неудачных попыток по снижению массы тела и его удержанию;
- наследственная предрасположенность к сахарному диабету 2 типа, ССЗ;
- наличие факторов риска и/или ассоциированных заболеваний (дислипидемия, гиперинсулинемия, сахарный диабет 2 типа, АГ и т. д.).
По рекомендации Национального института здоровья США в случае снижения массы тела на фоне фармакотерапии в течение первого месяца лечения менее чем на 2 кг препарат отменяется или заменяется другим.
Некомпенсированные психические и тяжелые соматические заболевания, а также беременность и лактация являются временными противопоказаниями для назначения медикаментозного лечения. Фармакотерапия по лечению ожирения не назначается пациентам моложе 16 и старше 65 лет, поскольку в этих возрастных категориях больных не проводились исследования по безопасности ее применения.
В настоящее время препаратами первого ряда для лечения непосредственно ожирения являются сибутрамин и орлистат; так как их эффективность доказана в ходе качественных многоцентровых клинических исследований, они могут назначаться в течение длительного времени и не оказывают серьезных побочных эффектов.
Сибутрамин (Меридиа) — препарат центрального действия нового поколения. Механизм действия сибутрамина заключается в селективном торможении обратного захвата серотонина и норадреналина в синапсах ЦНС. В отличие от других препаратов, он не влияет на допаминергическую систему и не усиливает секрецию серотонина нейронами ЦНС, поэтому не вызывает лекарственной зависимости, развития легочной гипертензии и клапанных пороков сердца. Таким образом, сибутрамин оказывает двойной эффект: усиливает и продлевает чувство насыщения, снижает объем потребляемой пищи, а также увеличивает термогенез, тормозя снижение скорости метаболизма, происходящее на фоне похудения и помогая таким образом удерживать массу тела на достигнутом уровне.
Наиболее часто сибутрамин используется в дозе 10–15 мг/сут, максимальная дозировка составляет 30 мг/сут. Клиническая эффективность использования сибутрамина подтверждена результатами многоцентрового рандомизированного плацебо-контролируемого исследования STORM, которое проводилось в течение 2 лет с участием 605 больных в возрасте от 17 до 65 лет с ИМТ 30–45. Эффективность сибутрамина составила 93% (снижение массы тела на 5% и более), у 54% больных вес снизился более чем на 10%. Есть данные об использовании сибутрамина у подростков. R. Bercowitz et al. показали, что применение сибутрамина в сочетании с поведенческой терапией у подростков в возрасте 13–17 лет с ИМТ от 32 до 44 в течение 6 мес привело к снижению массы тела в среднем на 7,8 кг; на 3,2 кг — на фоне плацебо. Снижение ИМТ на 10% было достигнуто у 40% подростков, получавших терапию сибутрамином и изменивших образ жизни, и у 15% — на фоне плацебо.
Согласно данным FDA, использование сибутрамина сопровождается не только снижением массы тела, но и улучшением липидного спектра крови, показателей гликемии, мочевой кислоты. В исследовании STORM отмечено снижение уровня триглицеридов на 20% и повышение уровня холестерина ЛПВП на 21%. Показано, что применение сибутрамина в сочетании с низкокалорийной диетой приводит к уменьшению массы миокарда левого желудочка; также выявлена статистически значимая корреляция между снижением массы тела на фоне лечения сибутрамином и уменьшением абсолютного риска развития ИБС (С. А. Бутрова). У больных сахарным диабетом 5-процентного снижения массы тела, по результатам проведенного в США исследования, достигли 33% больных; на 10% и более похудели 8% пациентов из группы, где применяли сибутрамин, при этом в группе с применением плацебо не похудел ни один больной. В среднем снижение массы тела на фоне применения сибутрамина составило 4,3 кг, а на фоне плацебо — только 0,3 кг. При этом снижение массы тела в группе пациентов с сахарным диабетом 2 типа, получавших сибутрамин, сопровождалось улучшением показателей гликемии. Наиболее значимое улучшение метаболизма глюкозы наблюдалось у больных, снизивших массу тела на 10%. В ряде исследований было выявлено, что снижение массы тела при лечении сибутрамином происходит преимущественно за счет жировой ткани, особенно в абдоминально-висцеральной области.
Исследование STORM, посвященное эффективности сибутрамина, длившееся 24 мес, показало следующие результаты:
- эффективность достигнута в 70% случаев;
- в отношении снижения веса в 3 раза эффективнее в сравнении с плацебо;
- в отношении уменьшения объема талии в 1,9 раза эффективнее в сравнении с плацебо;
- объем висцерального жира уменьшился на 22% от исходного.
Лечение сибутрамином больных сахарным диабетом, дислипидемией может продолжаться и при незначительном снижении массы тела при условии положительного влияния на углеводный и липидный обмен. Как известно, сибутрамин активирует симпатическую нервную систему, что вызывало опасения при использовании его у больных с ожирением и АГ. В группах пациентов, принимавших препарат, было отмечено повышение уровней систолического АД (на 0,3–2,7 мм рт. ст.), диастолического АД (на 1,6–3,4 мм рт. ст.) и частоты сердечных сокращений на 2–5 уд/мин, однако при уменьшении массы тела на фоне приема сибутрамина наблюдалось снижение показателей АД (С. А. Бутрова). Тем не менее при применении сибутрамина рекомендуется мониторинг уровня АД и частоты сердечных сокращений: каждые 2 нед в течение первых 3 мес лечения, ежемесячно последующие 3 мес и ежеквартально на протяжении следующих 6 мес лечения. Пациентам с неконтролируемой АГ или коронарной болезнью сердца сибутрамин не назначается.
К побочным эффектам сибутрамина относятся: повышение АД, тахикардия, сухость во рту, анорексия, бессонница, запоры. В 2003 г. начато исследование SCOUT (Sibutramine Cardiovascular Outcomes Trial) с целью оценки влияния снижения массы тела при применении сибутрамина на частоту развития приступов стенокардии, нарушений мозгового кровообращения и смертность от ССЗ у больных с ожирением и высоким риском сердечно-сосудистых событий. Исследование проводится в 300 центрах 17 стран мира. На сегодняшний день данные исследований и опыт, накопленный при применении сибутрамина в клинической практике показали, что применение препарата в сочетании с изменением образа жизни в значительной степени повышает эффективность терапии в плане достижения клинически значимого снижения массы тела и его последующего удержания, а также улучшения гликемического контроля и липидного профиля (особенно показателей триглицеридов и холестерина ЛПВП).
Орлистат (Ксеникал) — ингибитор желудочной и панкреатической липазы, действующий в пределах ЖКТ и не обладающий системными эффектами. Орлистат инактивирует фермент и таким образом препятствует расщеплению и последующему всасыванию около 30% жиров, поступающих с пищей, создавая тем самым дефицит энергии и способствуя снижению массы тела. Также орлистат уменьшает количество свободных жирных кислот и моноглицеридов в просвете кишечника, что в дальнейшем снижает уровень холестерина в крови. Рандомизированные двойные слепые плацебо-контролируемые исследования XENDOS (4 года непрерывного приема Ксеникала) по влиянию орлистата на снижение массы тела и предотвращение ее нарастания показали снижение массы тела в среднем на 10,3 кг, на фоне плацебо — на 6,1 кг, при этом в течение второго года лечения снижение массы тела на 10% и более сохранялось у 18–34% больных, получавших орлистат, против 6–17,5% в группе с применением плацебо. Помимо снижения массы тела на фоне лечения орлистатом отмечено уменьшение факторов риска ССЗ (гиперинсулинемия, гиперхолестеринемия), а также снижение массы висцеральной жировой ткани.
Орлистат назначается 3 раза в день по 120 мг во время еды или в течение часа после еды, обладает дозозависимым эффектом. Описаны такие побочные действия орлистата, как боли в животе, маслянистый, частый, жирный стул, позывы на дефекацию, метеоризм; при длительном приеме данного препарата возможно нарушение всасывания жирорастворимых витаминов.
Имеется опыт по совместному применению сибутрамина и орлистата как препаратов, воздействующих на разные механизмы ожирения, однако эффективность комбинированной терапии не доказана клиническими исследованиями.
Для лечения ожирения также используется симпатомиметик фентермин (Ионамин, Фастин) как препарат второго ряда. При приеме фентермина возможно развитие лекарственной зависимости, так как он относится к группе сильнодействующих препаратов. Кроме того, в отношении этого препарата не получено достоверных данных о положительном влиянии на другие аспекты ожирения: дислипидемию, гипергликемию. Известно применение некоторых антидепрессантов для лечения ожирения, в частности флуоксетина (Прозак), бупропиона (Велбутрин). Флуоксетин назначается при сочетании ожирения и депрессивных расстройств, при невротической булимии. Показанием к применению бупропиона является никотиновая зависимость у больных с ожирением (А. Ю. Рунихин, 2006).
Хирургические методы лечения ожирения. Хирургические методы лечения данного заболевания применяются с 1980 г., когда впервые хирургом E. Masson в США была проведена вертикальная гастропластика у больного с ожирением. В дальнейшем были разработаны и введены в практику различного рода рестриктивные и шунтирующие операции. Кроме оперативных хирургических методов существует альтернативный способ лечения ожирения в виде установки желудочного бандажа.
Показаниями к хирургической коррекции ожирения являются: длительность заболевания более 5 лет, ожирение II, III степени при отсутствии эффекта от медикаментозной терапии и наличии сопутствующих заболеваний, пациенты молодого возраста (до 30 лет) с ожирением I степени, быстро прогрессирующее ожирение при неэффективности консервативной терапии. Противопоказанием к хирургическому вмешательству служат хронический алкоголизм, психические заболевания, возраст менее 20 лет, перенесенные операции на желудке или острые язвы желудка.
Наиболее распространенным альтернативным методом лечения является установка внутрижелудочного силиконового баллона. В желудке баллон заполняется жидкостью и таким образом уменьшает размер желудка, что снижает объем принимаемой пищи и увеличивает чувство насыщения. Как правило, процедура установки баллона достаточно эффективна (снижение веса на 25% от исходного), однако после его удаления вес быстро восстанавливается (В. Н. Егиев, 2006).
К рестриктивным операциям (по уменьшению объема желудка) относят бандажирование желудка, резекцию большой кривизны желудка, вертикальную гастропластику (применяется редко). В настоящее время одним из популярных хирургических методов лечения ожирения является регулируемое бандажирование желудка, позволяющее при помощи специального бандажа поделить желудок на большой и малый, регулируя объем поступающей пищи через специальный порт, выведенный на переднюю брюшную стенку.
Показаниями к рестриктивным бариатрическим операциям служат:
- ИМТ более 40;
- ИМТ более 35 при прогрессировании ожирения и малоэффективной консервативной терапии;
- предпринимавшееся ранее лечение внутрижелудочным баллоном, если при этом больной остался «рефрактерным» к данному методу лечения;
- ожирение с тяжелыми сопутствующими заболеваниями (сахарный диабет, артрозы суставов, тяжелая гипертония и т.д.);
- заболевания брюшной полости, требующие хирургического лечения.
Эффективность бандажирования составляет около 90%, масса тела снижается до 40% от исходного, результат сохраняется в течение не менее 5 лет (В. Н. Егиев, 2006).
Резекция большой кривизны желудка является наиболее современным методом лечения ожирения. В данном случае лапароскопически производится удаление большой кривизны желудка от антрального отдела до угла Гиса, после чего желудок представляется в виде трубки диаметром около 3 см. Эффективность этой операции также очень высока — 95–97%, снижение веса достигает 40% от исходного; кроме того, косметически резекция большой кривизны выгоднее, чем бандажирование, и не требует постоянной регуляции (В. Н. Егиев, 2006).
Шунтирующие бариатрические операции направлены на создание малого желудка и выключение из пищеварения двенадцатиперстной кишки и части тонкого кишечника. Показаниями для шунтирующих операций являются:
- ИМТ более 45;
- ИМТ более 40 и отказ больного придерживаться диеты, которая рекомендована при других операциях (особенно отказ в ограничении приема сладкой пищи);
- сопутствующие заболевания, требующие значительного снижения веса, например, сахарный диабет и артрозы, требующие протезирования сустава;
- молодой возраст больного и быстрое увеличение массы тела;
- ИМТ более 40 и отсутствие эффекта от установки внутрижелудочного баллона.
Из шунтирующих операций наиболее распространены гастрошунтирование и билиопанкреатическое шунтирование (операция Скопинаро). Снижение веса при данных вмешательствах достигает 60–70% от исходного, однако существуют отрицательные эффекты после выполнения шунтирующих операций: жидкий многократный стул, связанный с эффектом «проваливания» пищи, нарушение обмена микроэлементов, витаминов.
В ряде случаев до и после хирургического лечения назначается сибутрамин для коррекции пищевого поведения и улучшения последующей адаптации пациента к приему небольшого количества пищи.
Следует учесть, что до проведения любого хирургического вмешательства должны быть полностью компенсированы сопутствующие заболевания, ведение больного следует осуществлять, тесно взаимодействуя с другими специалистами. Кроме того, для всех хирургических методов коррекции избыточного веса не существует серьезной доказательной базы по отдаленным результатам.
Таким образом, анализ литературы показал, что на сегодняшний день в лечении ожирения используются специализированная диета, увеличение физической активности, препараты, способствующие снижению веса, при неэффективности перечисленных методов — хирургическая коррекция.
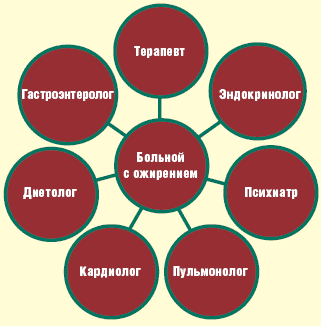
Кто же определит показания и противопоказания к тому или иному методу лечения? Первым специалистом, с которым предстоит встретиться пациенту с ожирением, должен быть терапевт, определяющий все последующие шаги больного (рис. 1).
|
| Рис. 1. Первый этап ведения больного с ожирением |
После обследования и выявления соматической патологии проводится ее коррекция. В ряде случаев после правильно подобранного лечения болезней-спутников ожирения последующего снижения веса не требуется, так как масса тела нормализуется самостоятельно. На этом этапе выявляются больные с эндокринопатиями, психическими проблемами, ятрогениями, вызывающими ожирение. В дальнейшем с пациентом работает диетолог для создания оптимального рациона в каждом конкретном случае, также назначаются дозированные физические нагрузки. Проводится психологическая беседа, направленная на изменение поведенческих реакций, создание мотивации на снижение веса. По показаниям назначается терапия сибутрамином, орлистатом или комбинацией данных препаратов. Хирургическое лечение назначается при неэффективности медикаментозной терапии, при тяжелых формах ожирения, однако даже в этих случаях врачу необходимо тесное сотрудничество со смежными специалистами: терапевтом, психологом, диетологом и др. Например, в случае сопутствующего сахарного диабета коррекция гипогликемической терапии должна осуществляться эндокринологом, а в случае артериальной гипертензии, ИБС — кардиологом.
Таким образом, в связи с тем, что в последние десятилетия проблема избыточного веса становится актуальной для все более широких слоев населения, разработаны эффективные способы лечения ожирения, которые позволяют повысить качество жизни пациента, снизить смертность от осложнений ожирения (рис. 2). Проблему коррекции ожирения необходимо решать, применяя все допустимые методы лечения с учетом особенностей каждого пациента.
Е. В. Кривцова, кандидат медицинских наук, доцент
Междисциплинарное научное общество бариатрической медицины, МГМСУ, Москва
Врезки:
