Проблема боли при остеоартрозе
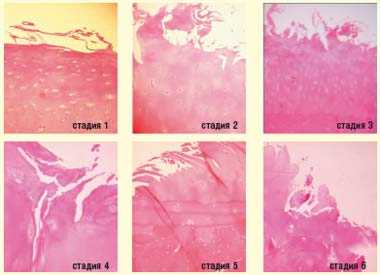
Деформирующий остеоартроз является заболеванием, поражающим значительную часть населения. Около 80% среди всех пациентов с заболеваниями суставов составляют именно больные остеоартрозом [1]. Двадцатый век ознаменовался множеством технических новшеств, которые во многом изменили быт людей. С одной стороны, облегчение физического труда уменьшило нагрузки на суставы человека, но с другой — именно появление многих технических приспособлений привело к увеличению числа случаев развития артроза у людей определенных профессий: бурильщиков, шахтеров, лиц, работающих на виброустановках, и т. д. Развитие транспортных средств привело к снижению двигательной активности значительной части населения, возрастание материального благополучия — к увеличению массы тела более чем у половины населения земного шара. Многие годы считалось, что остеоартроз является следствием возрастного «изнашивания» хряща. Однако патогенез заболевания намного сложнее (рис. 1). Как показано на рисунке 1, существует очень большое количество факторов, влияющих на развитие и прогрессирование основных звеньев патогенеза: деструкция хряща, синовиальное воспаление, ригидность субхондральной кости. Остеоартроз возникает в результате взаимодействия механических и биологических факторов. Этот процесс возникает либо в связи с изменениями в хряще или в субхондральной кости, либо в результате заболевания внутри самих этих тканей (например, генные дефекты 11-го типа коллагена, охроноз), либо как результат воздействия внешнего аномального механического стресса (при нестабильности сустава, повышенной нагрузке, травмах). По мере прогрессирования заболевания изменения хряща при остеоартрозе становятся более выраженными (рис. 2).
|
| Рисунок 2. Прогрессирование деструкции хряща |
Основными клиническими проявлениями остеоартроза являются боль и постепенное снижение функции. По современной классификации, характер боли определяется в зависимости от основного патогенетического механизма: ноцицептивного, невропатического, функционального (или дисфункционального).
При остеоартрозе основным механизмом развития боли является ноцицептивный, хотя у пациентов может наблюдаться и боль невропатического характера, на что следует обращать внимание при выработке терапевтической тактики. Именно болевой синдром становится фактором, ограничивающим активность пациентов и приводящим к формированию «болезненного поведения» (рис. 3). Хотя болевой синдром при остеоартрозе, особенно в дебюте болезни, выражен не столь сильно, как при хронических воспалительных артрологических заболеваниях, однако усилия врача должны быть направлены на максимальное подавление хронической боли. Хронический болевой синдром является значимой медицинской проблемой. Развитие боли приводит к функциональным нарушениям деятельности сердечно-сосудистой системы, системы дыхания, пищеварения и др. [2]. По данным телефонного опроса 46 394 респондентов из 16 европейских стран (рис. 4), 19% людей страдают от выраженной хронической боли [3] с интенсивностью не менее 5 баллов по 10-балльной визуальной аналоговой шкале (ВАШ). А наиболее распространенной причиной хронической боли является именно остеоартроз (рис. 5). Известно, что развитие заболевания у женщин приводит к уменьшению продолжительности жизни в среднем на 10–15 лет [4]. Однако показано, что уменьшение продолжительности жизни у пожилых людей в большей степени зависит от интенсивности боли (рис. 6), чем от наличия или отсутствия жизнеугрожающих заболеваний (например, ИБС, артериальная гипертензия и др.) [5]. При оценке выживаемости 1525 больных, из которых 370 страдали остеоартрозом (24%), 246 — сердечно-сосудистыми заболеваниями (16%), а 109 имели сочетание остеоартроза и сердечно-сосудистых заболеваний, оказалось, что относительный риск (95% CI) смерти за 5-летний период среди больных остеоартрозом, имевших интенсивность боли > 40 мм, по сравнению с лицами, у которых интенсивность боли была < 40 мм, составил 4,2, при отсутствии различий в возрасте и поле [5].
Таким образом, проблема боли при остеоартрозе носит не только медицинский, но и социальный характер и отражается на функциональной способности больных, их социальной активности и продолжительности жизни.
Разнообразие патогенетических механизмов, участвующих в формировании и прогрессировании остеоартроза, приводит и к развитию различных по происхождению болевых синдромов. Боль при этом может быть обусловлена различными причинами. Основным механизмом, приводящим к развитию болевого синдрома, считается постепенная деградация и снижение синтеза матрикса хряща, потеря им своих амортизационных свойств, нарушение баланса костного обмена в подлежащей кости с развитием остеофитов (рис. 7). Механическое давление на обнажающуюся кость приводит к появлению боли при физических нагрузках, даже небольших. Кроме того, при остеоартрозе развивается воспаление в синовиальной оболочке (вторичный синовит), что приводит к появлению утренней скованности и болей воспалительного характера. Вторичный синовит является практически облигатным признаком заболевания и наиболее распространенной причиной развития боли. Хотя считается, что синовит при остеоартрозе вторичен по отношению к деградации хряща, патогенетическое место воспаления при этом до конца не выяснено. Воспалительный компонент может присутствовать (по крайней мере у некоторых пациентов) в определенные фазы развернутой болезни. Например, может быть четкая гиперплазия синовии и инфильтрация мононуклеарными клетками, картина, не отличимая от ревматоидного артрита. Такое воспаление локально, наиболее выражено в местах примыкания синовии к хрящу. Но и синовит влияет на потерю хряща через продукцию воспалительных цитокинов, таких как интерлейкин-1 (ИЛ-1), который, в свою очередь, вызывает высвобождение матричных металлопротеиназ, таких как коллагеназы и стромелизин, простагландины и активаторы плазминогена. Известно, что у собак внутрисуставное введение антагонистов рецепторов ИЛ-1 уменьшает экспрессию коллагеназы и тормозит последующее развитие заболевания.
Боль при остеоартрозе может быть обусловлена повышением внутримедуллярного давления в субхондральной кости. Изменения субхондральной кости, видные на рентгенограммах у больных с установленным заболеванием, скорее позволяют предполагать их важную роль в развитии этого заболевания, чем рассматривать их как следствие повреждения хряща. Известно, например, что целостность хряща зависит от механических свойств подлежащей кости. Так, изменение субхондральной кости (возможно, после повторных микропереломов) вызывает отсутствие абсорбции давления. Роль обмена субхондральной кости при остеоартрозе подтверждается различными методами. В исследованиях in vivo на моделях морских свинок отчетливо проявлялись измерения в субхондральной кости до развития патологии хряща. В ходе проспективных исследований костные изменения, определяемые сцинтиграфически, предшествовали рентгенографическому прогрессированию в коленных суставах и суставах кистей, что сопровождалось увеличенной экспрессией в кости металлопротеиназ матрикса и щелочной фосфатазы при коксартрозе у человека.
Связь боли с определенным видом движения свидетельствует о поражении тканей, окружающих сустав, например при спазме периартикулярных мышц либо вследствие фиброза суставной капсулы при остеоартрозе. Преимущественно ночные боли в области крупных суставов или во всей конечности чаще всего обусловлены либо сосудистыми нарушениями (венозная гиперемия), либо невропатиями (туннельные, корешковые синдромы). Внезапные резкие боли при ходьбе с быстрым развитием синовита (блокада сустава) могут возникнуть при остеоартрозе вследствие внезапного внедрения остеофита в мягкие ткани или при попадании в полость сустава обломка остеофита или хряща.
Следует отметить, что при остеоартрозе отсутствует корреляция между рентгенологической стадией и клиническими проявлениями заболевания, ведущим среди которых является боль: рентгенологические проявления остеоартроза отмечаются примерно у 30% взрослого населения, а болевой синдром развивается у 10–12% [6].
В настоящий момент считается, что при остеоартрозе страдают все структуры, составляющие сустав, а также периартикулярные ткани. Это означает, что лечение заболевания представляет собой трудную комплексную задачу, требующую объединения усилий врачей различных специальностей: ревматологов, ортопедов, неврологов, хирургов. Социальная значимость данной патологии отражена в таблице 1.
Лечение суставного поражения при деформирующем остеоартрозе имеет свои особенности, что связано с многообразием причин, вызывающих боль в суставе или в его области при этом заболевании, а также с пожилым возрастом пациентов, нередко страдающих сопутствующими сердечно-сосудистыми, гастроэнтерологическими, эндокринологическими и другими заболеваниями. Основными направлениями лечения остеоартроза являются следующие.
- Подавление воспалительных факторов: секреции провоспалительных цитокинов; повышенной секреции простагландина Е2 (ПГЕ2); увеличенной активности ферментов синовиальной оболочки.
- Подавление деструктивных факторов: синтеза металлопротеиназ, деградации коллагеновых волокон, протеолитической активности; увеличение синтеза гликозаминогликанов (ГАГ).
- Подавление ригидности субхондральной кости.
- Улучшение лубрикации (смазывания) сустава, так как при остеоартрозе уменьшается вязкость и эластичность синовиальной жидкости, не только играющей роль «смазки», но и осуществляющей питание хряща, поскольку хрящ не имеет сосудов.
Длительное время лечение остеоартроза ограничивалось применением обезболивающих и противовоспалительных препаратов. Использование лекарственных средств других групп, влияющих, возможно, на патогенез заболевания, ограничивалось отсутствием убедительных доказательств их эффективности. Расширение и углубление представлений о природе заболевания и тонких механизмах его развития привело к пересмотру точки приложения и оценки патогенетической значимости большинства лекарств, применяемых в терапии остеоартроза. В настоящий момент имеется большой спектр противоартрозных препаратов, классификация которых представлена в таблице 2.
Учитывая, что при остеоартрозе боль наиболее часто обусловлена развитием синовита, нестероидные противовоспалительные препараты (НПВП) используются при этом заболевании чаще всего. Лечение вторичного синовита при остеоартрозе предъявляет определенные требования к НПВП — хорошая переносимость и возможность сочетать их с другими лекарственными средствами. Известно, что длительный прием неселективных НПВП связан с риском развития серьезных побочных действий — гастропатии, нефропатии, с ухудшением течения артериальной гипертензии и сердечно-сосудистой недостаточности, особенно у больных пожилого возраста [7, 8]. Кроме того, при применении НПВП отмечается нежелательное взаимодействие с рядом препаратов (антикоагулянты, противоэпилептические, антигипертензивные средства, сердечные гликозиды (дигоксин), диуретики), часто используемых в лечении сопутствующей патологии. Появление в последние годы НПВП, преимущественно или избирательно подавляющих синтез циклооксигеназы (ЦОГ) 2 типа, позволяет повысить безопасность лечения этого контингента больных [9]. При необходимости длительного приема, а также у лиц с наличием в анамнезе сведений о язвенно-эрозивном поражении желудочно-кишечного тракта назначение мовалиса (7,5–15 мг/сут) [10], нимесулида (100–200 мг/сут) или целебрекса (100–200 мг/сут) дает достаточный анальгетический и противовоспалительный эффект при минимальном риске побочных реакций.
Появление инъекционной формы мелоксикама для в/м введения дало существенные преимущества использования препарата в плане быстрого развития эффекта (начало терапевтического действия уже через 30 мин после введения), а также возможность применения способа «ступенчатой терапии»: введение мовалиса в первые 3–6 дней в/м для быстрого снятия обострения, с продолжением затем терапии тем же препаратом в той же дозе (15 мг), но в таблетированной форме.
Наличие новой формы нимесулида в виде гранулята позволяет повысить эффективность препарата за счет лучшей биологической доступности этой формы и достижения в сыворотке крови более высокой концентрации данного средства по сравнению с таблетированной формой. Учитывая тот факт, что ЦОГ-2 практически отсутствует в интерстициальной ткани почек, располагаясь преимущественно в почечных канальцах, специфические ингибиторы ЦОГ-2 (мелоксикам, целекоксиб) могут использоваться при начальной и умеренной стадии почечной недостаточности без уменьшения суточной дозы.
Неселективные в отношении ЦОГ НПВП усугубляют тяжесть остеоартроза при длительном применении, поэтому они должны применяться в низких дозах и короткими курсами. Показано, что при остеоартрозе на хрящ в наибольшей степени отрицательно влияют производные индолуксусной кислоты (индометацин) (рис. 8), хотя и производные пропионовой кислоты (ибупрофен, напроксен и др.) также на ~30% ускоряют, по данным рентгенографии, прогрессирование заболевания [11]. Все неселективные НПВП снижают синтез ГАГ, необходимых для регенерации хряща (рис. 9). Помимо того, что селективные ингибиторы ЦОГ-2 (мелоксикам, нимесулид, целекоксиб) лучше переносятся пожилыми пациентами с остеоартрозом вследствие реального уменьшения частоты побочных явлений со стороны желудочно-кишечного тракта, почек, печени [10], они не влияют на синтез ГАГ (рис. 10), а, подавляя ЦОГ-2, способны положительно воздействовать на ремоделирование костной ткани, так как активация остеокластов происходит при активном участии именно ЦОГ-2.
При превалировании механического типа болей в суставах при деструктивном остеоартрозе следует применять анальгетики типа парацетамола (500–2000 мг/сут) или трамадола (50–150 мг/сут). Ночные боли, связанные с сосудистыми нарушениями, хорошо купируются при применении трентала, периферических вазодилататоров. Лечение невропатических болей проводится с применением витаминотерапии. Широко используется локальная терапия дипроспаном для купирования туннельных синдромов, паравертебральные и невральные блокады дипроспана с новокаином — при корешковых синдромах и поражениях крупных нервных стволов.
Медленно действующие структурно-модифицирующие препараты, применяющиеся в лечении остеоартроза, представляют собой полученные из хряща животных или синтетическим путем компоненты матрикса хряща. Обладая комплексным механизмом действия и тропностью к хрящу, хондроитин сульфат и глюкозамин сульфат встраиваются в структуры хрящевой ткани, стимулируя ее синтез и угнетая деструкцию [15]. Основным критерием эффективности медленно действующих средств является уменьшение боли и потребности в применении НПВП, а также улучшение функциональных способностей больного [16]. Наиболее изученными средствами, применяющимися в лечении остеоартроза, являются хондроитин сульфат и глюкозамин — естественные компоненты хряща. Хондроитин сульфат представляет собой высокомолекулярный полисахарид из группы протеогликанов, является неотъемлемой частью аггрекановой молекулы хряща. Глюкозамин является субстратом для синтеза протеогликанов, продуцируется при гидролизе и деацетиляции хитина ракообразных. В лекарственные препараты, зарегистрированные в России, входят две соли глюкозамина — гидрохлорид (артра, терафлекс) и сульфат (дона, хондро).
И хондроитин сульфат, и глюкозамин обладают собственным обезболивающим и противовоспалительным действием, реализующимся не за счет подавления синтеза простагландинов, а путем подавления активности лизосомальных ферментов и ингибирования супероксидных радикалов. Положительное их влияние на хрящ обусловливается подавлением катаболических процессов и стимуляцией анаболических процессов в хряще. Следует отметить, что окончательно положительное влияние этих препаратов на течение остеоартроза оценить очень сложно. Для препаратов структум и дона в длительных контролируемых исследованиях было показано замедление рентгенологического прогрессирования заболевания, которое оценивалось по темпам сужения суставной щели коленного сустава [17, 18, 19]. Структурно-модифицирующие свойства и улучшение клинических симптомов остеоартроза тазобедренных суставов выявляются при применении пиаскледина 300 [20], коленных суставов — диацерина (ингибитора ИЛ-1), который готовится к регистрации в РФ. Интересно, что в исследованиях Reginster [17] и Pavelka [18], показавших достоверно меньший темп сужения суставной щели при трехлетнем лечении гонартроза препаратом дона, не было зарегистрировано корреляции уменьшения боли с замедлением прогрессирования остеоартроза. Поэтому основным критерием эффективности медленно действующих препаратов при остеоартрозе остается уменьшение боли и, соответственно, потребности в обезболивающих препаратах, а также улучшение функциональной способности больного. Важным аспектом действия хондропротекторов является сохранение положительного эффекта после завершения полного курса лечения, в то время как после отмены быстро действующих средств боль и уменьшение функциональных возможностей больного быстро нарастают.
Большую роль в нормальном функционировании хряща играют гиалуроновая кислота и гиалуронан (препараты алфлутоп, остенил, ферматрон). Они осуществляют амортизационную и лубрикационную функцию, являются субстратом для синтеза протеогликанов, защищают болевые рецепторы синовиальной оболочки от раздражения, улучшая свойства синовиальной жидкости, облегчают проникновение питательных веществ и веществ, необходимых для построения матрикса хряща. Препарат алфлутоп обладает выраженной анальгетической и противовоспалительной активностью при лечении больных с различной локализацией патологического процесса. Следует отметить, что больные уже после первого внутрисуставного введения препарата отмечают явное уменьшение боли. По данным профессора Н. И. Коршунова и соавторов [21], алфлутоп оказывает позитивное воздействие на суставной хрящ. Доказаны несомненный рост высоты хряща, увеличение плотности хряща у ряда больных и даже появление визуализации хряща у больной с отсутствием его на бедренной кости до начала лечения алфлутопом, что может быть объяснено либо репаративными процессами, либо повышением гидрофильности хряща. Исследования, посвященные возможности алфлутопа оказывать регенерирующее влияние на хрящ, продолжаются. Доказанным можно считать развитие быстрого клинического эффекта, сохранение его в течение нескольких месяцев, отсутствие рентгенологического прогрессирования остеоартроза в течение 3 лет наблюдения. Данные о развитии каких-либо побочных реакций на фоне применения алфлутопа отсутствуют.
Внутрисуставно при остеоартрозе вводят препараты гиалуронана, имеющие различный молекулярный вес — 1,2–1,4 млн дальтон (ферматрон, остенил), 6 млн дальтон (с содержанием синвиска, гилана). Введение производных гиалуронана в сустав приводит к быстрому купированию боли, нормализации свойств синовиальной жидкости [22]. Необходимо строго соблюдать правила введения подобных препаратов в суставную полость. Врач должен обладать достаточной квалификацией, так как препараты гиалуронана должны быть введены точно в суставную полость, не следует пользоваться анестетиками, так как попадание их в полость сустава приводит к распаду препарата и снижению лечебного эффекта.
В соответствии с рекомендациями Европейской антиревматической лиги [23], пациентам с остеоартрозом показано сочетание фармакологических и нефармакологических (обучение больного, снижение веса, защита сустава, физические упражнения) методов лечения; следует учитывать локализацию поражения, выраженность боли и воспаления, факторы риска развития побочных реакций. Фармакологическое лечение проводится следующими препаратами:
- парацетамол;
- средства локальной терапии;
- НПВП при отсутствии эффекта от парацетамола, ингибиторы ЦОГ-2 при наличии факторов риска побочных реакций;
- опиоидные анальгетики;
- хондропротекторы;
- внутрисуставные глюкокортикостероиды.
Кроме того, может быть назначено ортопедическое, хирургическое лечение.
Следует отметить значимость ортопедических мероприятий при ведении больных остеоартрозом. Любое нарушение статики опорно-двигательного аппарата способствует более раннему развитию и прогрессированию болезни. Коррекция плоскостопия, ношение наколенников, применение ортезов при нестабильности периартикулярных тканей позволяют уменьшить болевой синдром и замедлить прогрессирование заболевания. Выраженные деформации суставов служат основанием для консультации больного с хирургом-ортопедом.
Таким образом, болевой синдром при остеоартрозе представляет собой значимую медицинскую проблему, что связано с большой распространенностью заболевания (~12% популяции), разнообразием причин боли, преимущественно пожилым контингентом больных, наличием многих групп фармакологических средств, место которых в лечении патологии клиницист обязан учитывать, медленным развитием структурно-модифицирующего эффекта лекарственных препаратов и трудностями, связанными с оценкой степени прогрессирования остеоартроза, с необходимостью проводить ортопедические и реабилитационные мероприятия в ходе комплексного лечения болезни.
Литература
- Рациональная фармакотерапия ревматических заболеваний: руководство для практикующих врачей. Т. III. Гл. 12. М.: Литтерра, 2003.
- Bonica J. J. The Management of Pain. 2nd ed. Vol. 1; 1990.
- Breivik H., Collett B., Ventafridda V. et al. Eur J Pain. 2005; [Epub ahead of print].
- Smith M. M., Ghosh P. Osteoarthritis: Current status and future directions// APLAR J. Rheum. 1998; V. 2: 27–53.
- Pincus T., Sokka T. Abstract presented during the American College of Rheumatology 2005 Scientific Sessions. San Diego, California.
- Smith M. M., Ghosh P. Osteoarthritis: Current status and future directions// APLAR J. Rheum. 1998; V. 2: 27–53.
- Ruoff G. Management of pain in patients with multiple health problems: a guide for the practicing physician// Amer. J. Med. 1998; 105 (1B): 53–60.
- Janssen M., Dijkmans B., van der Sluijs F. A. Upper gastrointestinal complaints and complication in chronic rheumatic patients in comparison with other chronic diseases// Br. J. Rheum. 1992; Vol. 31: 747–752.
- Ruoff G. Management of pain in patients with multiple health problems: a guide for the practicing physician// Amer. J. Med. 1998; 105 (1B): 53–60.
- Garcia Rodriguez L. A., Hernandez-Diaz S. The relative risk of upper gastrointestinal complications among users of acetaminophen and non-steroidal anti-inflammatory drugs// Epidemiology. 2001; 12: 570–576.
- Ostensen M. Cartilage changes in arthritis do non-steroidal antiphlogistics have positive or negative effects?// Tiddsskr-Nor-Laegeforen. 1991; V. 111: 838–840.
- Haskinsson E. C., Berry H., Gishen P. et al. Effects of anti-inflammatory drugs on the progression of osteoarthritis of the knee// J. Rheum. 1995; 22: 1941–1946.
- Rashad S., Revell P., Hemingway A. et. al. Effect of non-steroidal anti-inflammatory drugs on the course of osteoarthritis// Lancet. 1989; i: 519–522.
- Hajjal H. E. L., Marcelis A., Devogelaer J. P., Manicourt D. H. Celecoxib has a positive effect on the overall metabolism of hyaluronan and proteoglycans in human osteoarthritic cartilage// J. Rheum. 2003; 30: 2444–2451.
- Рациональная фармакотерапия ревматических заболеваний: руководство для практикующих врачей. Т. III. Гл. 12. М.: Литтерра, 2003.
- Lequesne M., Brandt K., Bellamy N. et al. Guidelines for testing slow acting drugs in osteoarthritis// J. Rheum. 1994; V. 21: 65–73.
- Reginster J. Y., Deroisy R., Rovati L. C. et al. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomized, placebo-controlled clinical trial// Lancet. 2001; V. 357: 251–256.
- Pavelka K., Gatterova J., Olejarova M. et al. Glucosamine Sulfate use and delay of progression of knee osteoarthritis// Arch. Int. Med. 2002; V. 162: 2113–2122.
- Алексеева Л. И. Современные подходы к лечению остеоартроза// РМЖ. 2003. Т. 11. № 4. С. 201–205.
- Lequesne M., Maheu E., Cadet C. et al. Structural effect of Avocado/Soybean Unsaponifables on joint space loss in osteoarthritis of the hip// Arth.Care Res. 2002; 47: 50–58.
- Коршунов Н. И., Баранова Э. Я., Парусова Н. И. и др. Алфлутоп в лечении больных остеоартрозом// Российская ревматология. 1998. № 2. С. 26–31.
- Mensitieri M., Ambrosio L., Iannace S. et al. Viscosoelastic evaluation of different knee osteoarthritis therapies// J. Mat. Med. 1995; 6 (3): 130–130.
- Jardan K. M., Arden N. K., Bоnnwarta B. et al. EULAR recommendations 2003: an evidence based approach to the report of Task force of the standing Committee for International Clinical Studies including therapeutic trials// Ann. Rheum. Dis., 2003. P. 1–13.
Н. В. Чичасова, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
Врезки:
