Клиника, диагностика и коррекция острого лекарственного гепатита
Диагностика лекарственных поражений печени вызывает множество трудностей, так как клиническая картина при этих заболеваниях может имитировать различные заболевания печени другой этиологии. Чтобы точно установить диагноз, необходимы определенная настороженность в этом плане и тщательный сбор анамнеза (с уточнением всех принимаемых препаратов и биодобавок). Важно также уточнить, какие лекарства принимались пациентом за последние несколько месяцев, так как действие некоторых антибиотиков (таких как амоксиклав и эритромицин) может быть отсрочено, а латентный период составляет до 6 нед. При подозрении на наличие другой патологии печени необходимо провести серологические тесты на вирусный гепатит, антинуклеарные антитела, антитела к гладкой мускулатуре и антимитохондриальные антитела. В некоторых случаях назначаются исследования уровня железа крови, церулоплазмина и определяется фенотип α1-антитрипсина. Для исключения заболеваний желчевыводящих путей проводится ультразвуковое исследование. Гипотензия, сепсис, ишемическая болезнь сердца и алкоголизм должны быть исключены или выявлены перед установкой окончательного диагноза. Также необходимо исключить наследственную недостаточность ферментных систем печени.
Уровень аминотрансфераз увеличивается при повреждении паренхимы печени различной этиологии: вирусный гепатит, лекарственные препараты или их метаболиты, аутоиммунный гепатит, и некоторые инфильтративные нарушения, как гемохроматоз, дефицит α1-антитрипсина и жировая дистрофия печени. Конечно, при некоторых заболеваниях могут быть также в некоторой степени повышены щелочная фосфатаза и гамма-глутамилтранспептидаза, но в случае отсутствия обструкции желчных путей или наличия значительного нарушения функционирования печени уровень билирубина остается нормальным. Наиболее распространенной причиной повышения аламинаминотрансферазы (АЛТ) является токсичность лекарственных средств. Длительное использование препарата, повреждающего печень, часто приводит к повышению уровня АЛТ, но ее значения не превышают 300 ЕД/л. Препаратами, наиболее часто вызывающими поражение печени, являются нестероидные противовоспалительные препараты, антибиотики, статины, лекарственные средства для купирования приступа, противовирусные препараты, в особенности использующиеся для лечения вируса иммунодефицита человека, а также цитостатики. При употреблении вышеуказанных препаратов необходимо постоянно контролировать уровень ферментов печени. В настоящее время все большее значение придается поражениям печени, вызванным приемом лекарственных трав, но гепатотоксичность многих из них требует дополнительных исследований (рис.).
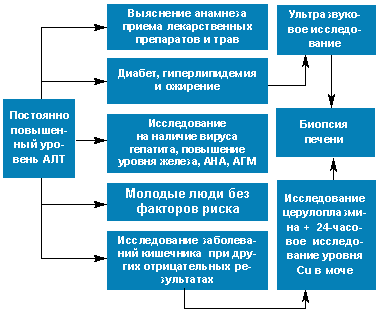
|
| Рисунок. Алгоритм выявления причин постоянного повышения АЛТ. АНА — антинуклеарные антитела, α1-АТ – α1-антитрипсин, Cu — медь, АГМ — антитела к гладкой мускулатуре |
Представляем описание случая острого лекарственного гепатита (ОЛГ), вызванного 6-меркаптопурином.
У больного Ф. 50 лет был диагностирован острый миелобластный лейкоз. Проведены 3 курса цитостатической терапии — CVAMP, VAMP и COAP, включающей назначение винкристина, метотрексата, 6-меркаптопурина, циклофасфана, цитозара, преднизолона. Течение заболевания осложнилось острым холестатическим гепатитом, лейкопенией, очаговой пневмонией, в связи с чем курс консолидации (эндоксан, цитозар, 6-меркаптопурин) был проведен через 1 мес после перерыва в лечении, длительность терапии составила 10 дней. При этом сохранялась ремиссия острого лейкоза. Объективно отмечались иктеричность склер и умеренная гепатомегалия. Биохимические показатели: уровень билирубина превышал норму в 1,5 раза, активность аминотрансфераз и щелочной фосфатазы — в 2 раза. После курса консолидации активность органоспецифических ферментов печени — глутаматдегидрогеназы — превысила нормальные показатели более чем в 2 раза, сорбитолдегидрогеназы — в 2 раза. Вирусы гепатитов А, В, С, D, Е, G в сыворотке крови не выявлены, как и маркеры TTV СMV, герпеса 1 и 2 типа антинуклеарные антитела. Амбулаторно рекомендован прием 6-меркаптопурина, через 1 мес от начала лечения которым у больного появились кожный зуд по ночам и периодическое потемнение мочи. Через 46 дней после курса консолидации был назначен очередной курс лечения основного заболевания в стационаре. Гематологические показатели, в том числе и данные стернальной пункции, свидетельствовали о ремиссии острого лейкоза.
Продолжено лечение 6-меркаптопурином. Больной жаловался на кожный зуд, слабость. При осмотре отмечались желтушная окраска склер и кожных покровов, яркие «печеночные» ладони, увеличенная печень с гладким, болезненным, плотноватым краем. Для уточнения характера желтухи проведено ультразвуковое исследование желчного пузыря, вследствие чего были выявлены признаки калькулезного холецистита, при эндоскопической ретроградной холангиопанкреатографии определялись «дефекты» в общем желчном протоке и желчном пузыре. Диагностированы желчнокаменная болезнь, холедохолитиаз. От предложенной операции больной отказался. В дальнейшем продолжала нарастать желтуха, усилился кожный зуд. При этом уровень билирубина нарастал, превысив 26 норм, преимущественно за счет прямого — 15 норм. Активность щелочной фосфатазы превышала нормальные показатели в 3 раза, аминотрансфераз — в 2 раза. Учитывая нарастание желтухи, данные лабораторных и инструментальных исследований, больному рекомендовано оперативное лечение по поводу желчнокаменной болезни с холедохолитиазом. При лапаротомии было выявлено выраженное сращение между желчным пузырем и большим сальником. Желчный пузырь не увеличен, мягкий, конкрементов не содержал. Для уточнения диагноза выполнены пункция желчного пузыря и биопсия печени. На холангиограмме теней, подозрительных на конкременты, не обнаружено, контрастное вещество свободно поступало в двенадцатиперстную кишку. Таким образом, данных в пользу механической желтухи получено не было. При гистологическом исследовании ткани печени отмечались дистрофические изменения, внутриклеточное накопление пигмента, медикаментозный холестаз. Высказано предположение о том, что у больного имеет место развитие лекарственного гепатита. Отменен 6-меркаптопурин. Назначена урсодезоксихолевая кислота (УДХК) (урсосан) в дозе 1000 мг, обладающая антихолестатическим, цитопротекторным эффектами, способствующая выведению токсических желчных кислот, являющаяся желчегонным средством. Через 12 дней уменьшилось желтушное окрашивание склер и кожных покровов, исчез кожный зуд. Уровень билирубина снизился, нормализовались активность ферментов (глутаматдегидрогеназы, сорбитолдегидрогеназы, гамма-глутамилтранспептидазы, аминотрансфераз), тимоловероналовая проба.
На основании вышеизложенного можно сделать следующие выводы.
У наблюдаемого больного на фоне лечения острого миелобластного лейкоза развился ОЛГ. При цитостатической терапии, которая сопряжена с продолжительной нагрузкой на печень, необходимо изучение в динамике функционального состояния печени в течение всего периода лечения, в связи с гепатотоксическим действием 6-меркаптопурина. При установлении диагноза ОЛГ 6-меркаптопурин должен быть временно отменен, рекомендуется использование урсосана в дозе 15мг/кг веса до нормализации печеночных проб. Препараты УДХК (урсосан), обладая высокими полярными свойствами, образуют нетоксичные смешанные мицеллы, уменьшая концентрацию токсичных для гепатоцитов желчных кислот и стимулируя холерез, что способствует эффективному разрешению внутрипеченочного холестаза. Кроме того, УДХК образует двойные молекулы, способные включаться в состав клеточных мембран гепатоцитов, холангиоцитов, и делает их невосприимчивыми к действию цитотоксических мицелл. УДХК, уменьшая насыщенность желчи холестерином за счет угнетения ее адсорбции в кишечнике, уменьшает литогенный индекс желчи, обладает иммуномодулирующей активностью, замедляет процессы старения и гибели гепатоцитов.
Таким образом, наличие синдрома холестаза требует проведения дифференциальной диагностики с вирусными и аутоиммунными поражениями печени, патологией желчевыводящих путей.
При наличии острого лекарственного гепатита по холестатическому типу необходима отмена лекарственного препарата, являющегося причиной развития ятрогенного поражения печени. Терапия препаратами УДХК (урсосаном) способствует ускорению разрешения внутрипеченочного холестаза и характеризуется иммуномодулирующей активностью, что актуально на фоне и после лечения иммуносупрессорами (6-меркаптопурином). Капсулы урсосана назначаются из расчета 10–15 мг/кг/сут под контролем клинико-лабораторных показателей холестаза.
Литература
- Ballet F. Hepatotoxicity in drug development: detection, significance and solutions// J Hepatol. 1997; 26. Suppl 2: 26–36.
- Danan G., Benichou C. Causality assessment of adverse reactions to drugs-I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries// J Clin Epidemiol. 1993; 46: 1323-1330.
- Degott C., Feldmann G., Larrey D. et al. Drug-induced prolonged cholestasis in adults: a histological semiquantitative study demonstrating progressive ductopenia// Hepatology. 1992; 17: 244–251.
- Farrell G. Liver disease caused by drugs, anesthetics, and toxins. In: Feldman M, Friedman LS, Sleisenger MH, editors. Sleisenger & Fordtran’s gastrointestinal and liver disease: pathophysiology, diagnosis, and management. 7th ed. Philadelphia: Saunders; 2002.
- Kaplowitz N. Drug-induced liver disorders: implications for drug development and regulation// Drug Saf. 2001; 24: 483–490.
- Kaplowitz N., Aw T. Y., Simon F. R., Stolz A. Drug-induced hepatotoxicity// Ann Intern Med. 1986; 104: 826-839.
- Keays R., Harrison P. M., Wendon J. A. et al . Intravenous acetylcysteine in paracetamol induced fulminant hepatic failure: a prospective controlled trial// BMJ 1991; 303: 1026–1029.
- Liu Z. X., Kaplowitz N. Immune-mediated drug-induced liver disease. Clin Liver Dis. 2002; 6: 755–774.
- Makin A. J., Wendon J., Williams R. A seven year experience of severe acetaminophen-induced hepatotoxicity (1987-1993)// Gastroenterology. 1995; 109: 1907–1916.
- O’Grady J. Paracetamol-induced acute liver failure: prevention and management// J Hepatol. 1997; 26 Suppl 1: 41–46.
- Ostapowicz G., Fontana R. J., Schiodt F. V. et al. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States// Ann Intern Med. 2002; 137: 947–954.
- Schimdt F. V., Rohling F. A., Casey D. L., Lee W. M. Acetaminophen toxicity in an urban county hospital// N Engl J Med. 1997; 337: 1112–1117.
- Seeff L. B., Cuccherini B. A., Zimmerman H. J. et al. Acetaminophen hepatotoxicity in alcoholics: a therapeutic misadventure// Ann Intern Med. 1986; 104: 399–404.
- Smilkstein M. J., Knapp G. L., Kulig K. W., Rumack B. H. Efficacy of oral N-acetylcysteine in the treatment of acetaminophen overdose// N Engl J Med. 1988; 319: 1557–1562.
- Stieger B., Fattinger K., Madon J. et al. Drug- and estrogen-induced cholestasis through inhibition of the hepatocellular bile salt export pump (BSEP) of rat liver// Gastroenterology. 2000; 118: 422–430.
Т. Е. Полунина, доктор медицинских наук, профессор
И. В. Маев, доктор медицинских наук, профессор
МГМСУ, Гута-Клиник, Москва
