Тяжелое упорное течение атопического дерматита: особенности лечения у детей
24.11.2005
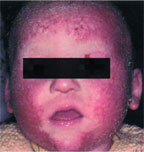
Эксперты международного согласительного документа по атопическому дерматиту (США, 2002) при тяжелом упорном течении заболевания, рефрактерном к терапии топическими ингибиторами кальциневрина и интермиттирующими курсами топических кортикостероидов (ТКС), рекомендуют в зависимости от особенностей каждого пациента назначать: ТКС высокой активности, фототерапию, иммуносупрессанты в качестве монотерапии или в сочетании с психотерапевтическими и психофармакологическими методиками [1]. Это так называемые резервные терапевтические подходы, которые более широкое распространение получили в лечении атопического дерматита (АД) у взрослых, нежели у детей. Так, в литературе (особенно отечественной) практически не представлены рандомизированные клинические исследования относительно использования фото- и иммуносупрессирующей терапии при АД, в которых содержалась бы достаточно обоснованная аргументация и рекомендации по их применению в педиатрической практике. Очень мало внимания сегодня уделяется также психологической и психофармакологической поддержке больного ребенка и ухаживающих за ним лиц.
Остановимся на некоторых особенностях применения вышеперечисленных методов лечения АД.
ТКС с высокой активностью
Напомним, что активность ТКС варьирует от очень высокой (класс IV) до низкой (класс I). Препараты ТКС высокой активности перечислены в таблице.
За рубежом применение ТКС класса IV в лечении АД у детей не рекомендуется. Ведущий специалист по АД профессор D. Leung советует: прежде чем пациенту, страдающему АД, назначить высокоактивный ТКС, врачу следует уточнить комплаентность, а также удостовериться в правильности диагноза заболевания [2].
Показания к использованию ТКС при АД до сих пор не стандартизированы. Клиническая практика показывает, что существует ряд объективных и субъективных причин довольно частого применения ТКС высокой активности. Сегодня одной из таких главных причин являются социально-экономические проблемы в России, не позволяющие существенно изменить подход к терапии пациентов с АД: большинство из них не могут приобрести современные дорогостоящие топические противовоспалительные и другие наружные средства, требующие длительного применения. Известно также, что стоимость многих фторированных ТКС гораздо ниже стоимости более безопасных гормональных препаратов нового поколения.
Помимо уточнения двух вышеуказанных очень важных параметров — диагноза заболевания и комплаентности — врачу необходимо также учесть некоторые особенности, присущие течению самого АД, прежде всего гиперреактивную способность экзематозной кожи (особенно у пациентов детского возраста) легко реагировать на контактные ирритантные воздействия, пищевую гиперчувствительность, эмоциональные и физические факторы. Есть и другие важные моменты, в частности нарушение общепринятых рекомендаций по применению ТКС со стороны врача и самого пациента: нередко больным сразу назначают галогенизированные (чаще фторированные) ТКС; не соблюдаются правила общего ухода за кожей и т. п. Так, сегодня не вызывает сомнений тот факт, что ТКС следует применять коротким курсом (2–4 нед у детей и до 6 нед у взрослых) только для лечения обострений АД, но не в целях их профилактики [1, 3]. Очень важно параллельно использовать смягчающие/увлажняющие средства, эффективность которых при АД с позиций доказательной медицины предполагается [1–4]. Установлено, что регулярное использование таких средств способствует предотвращению развития обострений АД у 1/3 больных, а в некоторых случаях отмечается даже эквивалентная эффективность применения увлажнителей и ТКС. Обязательное применение увлажняющих средств в лечении АД обосновано также наличием сухости кожи из-за трансэпидермальной потери воды, что приводит к повышению системной абсорбции ТКС, а следовательно, и к усилению их побочных эффектов.
Причины неэффективности ТКС при АД
У ряда больных даже в случае длительного применения ТКС сохраняется тяжелая форма АД. Так, по данным M. Furue и соавторов, из 210 младенцев она отмечалась у 7% пациентов, а из 546 детей старшего возраста и 515 взрослых — у 10 и 19% соответственно, несмотря на использование ТКС сохранялось тяжелое или очень тяжелое течение АД [5].
Почему это происходит? Прежде всего врачу следует удостовериться в соблюдении выбранного режима терапии [2]. Выбор ТКС зависит от степени тяжести и локализации очагов поражения. Общим правилом является использование наименее активного из числа эффективных препаратов. Однако применение в начале терапии слишком слабого препарата может привести к ухудшению или персистированию течения АД и нарушениям режима терапии [6]. В то же время если больному изначально назначить высокоактивный ТКС коротким курсом без планового снижения объема терапии, у него также может развиться синдром отмены в виде рецидива обострения заболевания [2, 6].
Значительно лучше соблюдается режим терапии при возможности однократного ежедневного применения ТКС, например метилпреднизолона ацепоната (адвантан) (его назначают детям с 6-месячного возраста) или мометазона фуроата (элоком) (разрешено применять у детей после 2 лет жизни) [7]. Некоторые исследователи считают, что лечение высокоактивным ТКС коротким курсом (3 дня) может не уступать по клинической эффективности терапии, предполагающей частое и длительное применение низкоактивного ТКС [8].
Еще одна причина неэффективности терапии и неконтролируемого течения АД — применение ТКС в неадекватном количестве. Известно, что взрослому больному с распространенной формой АД необходимо нанести на все тело ~30 г препарата. У детей в качестве меры нанесения ТКС предложена единица FTU (fingertip unit — единица, равная кончику пальца), определяемая как количество препарата, выдавленного из тюбика на концевую фалангу указательного пальца [9]. Считается, что ~1 FTU требуется, чтобы нанести препарат на кисть руки или пах, 2 FTU — на лицо или ступню, 3 FTU — на руку целиком, 6 FTU — на ногу целиком и 14 FTU — на туловище.
Другая причина неэффективности ТКС — продолжающаяся экспозиция аллергенов (аэро-, пищевых). Здесь важно уточнить, насколько скрупулезно пациент и ухаживающие за ним лица соблюдают правила, направленные на ограничение воздействия провоцирующих факторов.
Подтвержденная клинически неэффективность даже высокоактивных ТКС может объясняться влиянием стафилококковых суперантигенов на экзематозное воспаление в коже [1, 2, 10].
Возможно, резистентность к стероидам развивается в результате повышения экспрессии глюкокортикоидных рецепторов типа β — мощного ингибитора глюкокортикоидов.
Также недавно было высказано важное предположение, согласно которому в коже больных АД отмечается дефицит антимикробных пептидов — одной из составных частей врожденной иммунной системы, защищающей кожу от воздействия бактерий, вирусов и грибков, что может играть определенную роль в формировании резистентности к терапии АД [11].
В ряде случаев причиной видимой безуспешности терапии может быть аллергия к стероидам, проявляющаяся в виде аллергического контактного дерматита на применяемый ТКС.
Кроме того, в клинической практике, особенно это касается пациентов детского возраста, встречаются больные, которые не могут лечиться ТКС или им необходимо ограничить их применение. Недавно появившиеся на фармацевтическом рынке топические ингибиторы кальциневрина (такролимус, пимекролимус — элидел) представляют тот новый ряд лекарственных средств, которые могут замещать ТКС или значительно снизить потребность в нем [12, 13].
Всегда ли необходимо применять ТКС высокой активности? По аналогии с ингаляционными кортикостероидами, используемыми в лечении бронхиальной астмы, результаты практически всех рандомизированных клинических исследований свидетельствуют о значительном улучшении течения АД после применения любого из ТКС, имеющих разную потенциальную активность [3, 4].
Вместе с тем у пациента может существовать индивидуальная чувствительность к применяемым ТКС. Это убедительно подтверждено в оригинальном исследовании Р. Ainley-Walker и соавторов, которые оценивали эффективность различных ТКС после их одновременного нанесения симметрично на противоположные участки кожи у 66 детей с АД. Оказалось, что в 25 случаях ТКС сильного III класса был более эффективен, чем кортикостероид слабого класса; у 20 детей различий между слабым и сильным ТКС выявлено не было, а в 7 случаях ТКС слабого класса был даже эффективнее представителя сильного класса. Как считают авторы, нанесение ТКС различной противовоспалительной активности на симметричные участки кожи представляет собой простой и рациональный путь определения индивидуального оптимального режима лечения.
При лечении упорного тяжелого течения АД у детей и взрослых описано положительное влияние специальной влажной одежды, пропитанной раствором кортикостероида. Адреналовая супрессия и/или осложнения в виде фолликулита при этом встречались редко.
Сегодня к топическим препаратам, обладающим стероидсберегающим эффектом, можно отнести только ингибиторы кальциневрина такролимус (протопик) и пимекролимус (элидел) [1, 12, 13, 14, 15]. В США детям в возрасте старше 2 лет и взрослым, страдающим АД средней и тяжелой степени, рекомендуют назначать такролимус, тогда как пимекролимус показан для лечения легкой и средней степени тяжести заболевания [12, 14]. В недавно опубликованной статье S. Reitamo и соавторов приводятся данные рандомизированного клинического исследования, подтвердившего высокую эффективность такролимуса в лечении АД средней тяжести и тяжелой формы АД у детей. Результаты такого лечения были эквивалентны применению мази гидрокортизона ацетата [12]. Кроме того, по результатам оценки индекса SCORAD сочетанное применение топического ингибитора кальциневрина с ТКС по интермиттирующей схеме эффективнее комбинации ТКС и увлажняющего препарата [13]. Поскольку топический ингибитор кальциневрина и ТКС имеют разные противовоспалительные и, возможно, комплементарные механизмы действия, они могут быть использованы одновременно по показаниям (в том числе в зависимости от тяжести заболевания, пожелания больного и т. п.) [16].
Следует отметить, что после появления на фармацевтическом рынке топических ингибиторов кальциневрина подход к наружной терапии АД изменился. Сегодня в качестве индукционной терапии рассматривают четыре режима применения топических препаратов: высокоактивных ТКС; ТКС низкой активности; топических ингибиторов кальциневрина; комбинацию ТКС + топический ингибитор кальциневрина [17, 18]. После достижения улучшения, касающегося кожных проявлений АД, больному назначают поддерживающее лечение: монотерапию топическим ингибитором кальциневрина или ТКС низкой активности (его применяют по интермиттирующей схеме), или их комбинацию (возможно применение на разных участках кожи разных препаратов) [17].
Стероидсберегающий эффект антагонистов лейкотриеновых рецепторов доказан при бронхиальной астме, тогда как в случае применения монтелукаста в лечении больных со средней и тяжелой степенью тяжести течения АД разницы с плацебо получено не было [19].
Реально клиническое состояние каждого больного с АД может значительно улучшиться после обучения его самого и ухаживающих за ним лиц грамотному ограничению воздействия провоцирующих факторов и правильному выполнению рекомендаций врача [1–5]. Такой подход также является одним из важных этапов на пути существенного снижения потребности в ТКС.
При неэффективности ТКС высокой активности у больных с тяжелым упорным течением АД назначают фото- и иммуносупрессирующую терапию. Такой подход получил более широкое распространение в клинической практике за рубежом, в основном для лечения взрослых больных.
Фототерапия
Тот факт, что у части больных с АД в летние месяцы уменьшается число обострений заболевания, был положен в основу применения терапии ультрафиолетовым (УФ) светом. Сравнительных исследований по оценке безопасности и эффективности фототерапии при АД у детей мало, а накопленных данных в пользу ее широкого применения в педиатрической практике недостаточно [20, 21].
За рубежом прочно внедрены в практику в качестве полезного дополнения к терапии АД у взрослых широкополосная УФ-терапия в диапазоне В или диапазоне А, узкополосная фототерапия УФ-В (311 нм), УФ-А-1 (340–400 нм), ПУВА-терапия А-диапазона с псораленом и комбинированная терапия в диапазоне А и В. Некоторые литературные данные показывают, что все режимы терапии эффективны в лечении АД, хотя большинство взрослых больных предпочитают не принимать фотосенсибилизаторы [20, 21].
Фотоиммунологический эффект данного вида терапии объясняют воздействием УФ-лучей на активность клеток Лангерганса и кератиноцитов путем изменения продукции их цитокинов и снижения экспрессии HLA-DR и рецептора IL-2 на T-клетках [2]. В отличие от традиционной УФ-терапии в диапазоне A и B, которая мало эффективна при острой фазе АД, широкополосная УФ-A1 терапия достоверно снижает количество IgE-связывающих клеток в дерме, включая тучные и дендритные клетки, и ингибирует миграцию клеток Лангерганса из эпидермиса в дерму [2].
Однако в целом фототерапия представляет собой дорогое и неудобное в применении лечение. При ее применении также возрастает риск развития в будущем рака и/или преждевременного старения кожи [1, 21].
Исследования in vitro и эксперименты на животных подтверждают существование корреляции между облучением УФ-лучами и карциногенезом кожи или возникновением меланомы [20]. С целью минимизации нежелательных побочных эффектов назначают средние биодозы УФ-лучей: обычно у взрослых больных с острым обострением АД кумулятивная доза составляет 750 Дж/см2. В исследовании D. Abeck и соавторов подобная доза была достоверно эффективна (улучшение по шкале SCORAD) у взрослых пациентов через 1 мес после лечения, однако к концу 3-го месяца изменения на коже приняли тот же характер, что и до лечения [20].
Иммуносупрессирующая терапия
В случаях тяжелого упорного течения АД возможно применение таких иммуносупрессантов, как циклоспорин А, азатиоприн и метотрексат [1, 22].
Циклоспорин А — препарат полипептидной природы, выделенный из грибов Trichoderma polysporum. Связываясь с внутриклеточными специфическими рецепторами, он ингибирует кальциневрин и блокирует синтез различных цитокинов (IL-2, -3, -4, IFNγ) и активность Т-клеток [2]. Считается, что циклоспорин не влияет на аллергические реакции немедленного и замедленного типов, но подавляет зуд. По данным R. Bunikowski и соавторов, после лечения циклоспорином A у всех детей с тяжелым течением АД отмечалась достоверная супрессия продукции IL-6 и IL-8 мононуклеарными клетками крови, тогда как уровень TNFg не изменился ни в одном случае.
Также in vitro продемонстрирована способность циклоспорина А тормозить дегрануляцию тучных клеток кожи и синтез лейкотриенов.
Как известно, тяжелое течение АД часто ассоциируют с экзотоксинами, продуцируемыми золотистым стафилококком. Лечение циклоспорином А способствовало улучшению клинических симптомов АД (по шкале SCORAD, p < 0,001) и уменьшению бактериальной колонизации кожи стафилококком у детей с тяжелой формой АД. В то же время, как считают авторы, еще до назначения иммуносупрессанта таким пациентам следует провести курс антибактериальной терапии.
В 2000 г. в Великобритании было принято соглашение по применению циклоспорина А при АД у детей. Эксперты подчеркивают, что препарат является резервным и предназначен для лечения рефрактерного к стандартной наружной терапии тяжелой формы АД. Из-за токсичности назначение циклоспорина А требует тщательного наблюдения за пациентом и мониторинга его артериального давления и ренальной функции. Противопоказания для применения циклоспорина А — инфекционные заболевания в острой фазе, нарушение функции почек, печени.
Циклоспорин А в форме раствора для приема внутрь назначают детям в начальной дозе 5 мг/кг 2 раза в сутки, затем, по мере улучшения состояния больных, дозу препарата постепенно снижают до 2,5 мг/кг в сутки [22]. Общая продолжительность лечения составляет от 6 нед до нескольких месяцев.
При применении циклоспорина А уменьшение зуда и гиперемии кожи отмечается уже в первые дни приема препарата. Однако иммуносупрессирующая терапия в низких дозах обеспечивает лишь временное облегчение симптомов АД: более половины больных уже через 2 нед после прекращения приема циклоспорина А отмечают ухудшение симптомов АД, и лишь у 1/6 из них улучшение сохраняется в течение года. Недавно проведенное рандомизированное исследование подтвердило отсутствие влияния лечения циклоспорином А на качество жизни больных, страдающих АД.
Как известно, лечение циклоспорином А также не приводит к улучшению показателей функции легких у пациентов с тяжелой бронхиальной астмой, хотя симптоматика болезни заметно улучшалась на фоне значительного снижения дозы пероральных кортикостероидов [42]. Интересно отметить, что ингибирования активности клеток воспаления и снижения уровня воспалительных цитокинов в процессе терапии выявлено не было.
Метотрексат появился в 1948 г. и применялся первоначально в качестве противоопухолевого препарата, однако с 1960-х гг. его стали использовать при лечении псориаза и других кожных заболеваний. В недавно опубликованной работе F. Shaffrali и соавторов показана высокая эффективность низких доз метотрексата, который использовался в качестве терапии «отчаяния» у пожилых больных с АД [23].
Новый ингибитор биосинтеза пуринов микофенолата мофетил (mycophenolate mofetil), назначающийся при трансплантации и профилактике отторжения почек, был недавно с успехом применен в лечении тяжелой формы АД у взрослых пациентов [24]. Однако использование этого антиметаболита, как и азатиоприна, сопряжено со значительным риском токсичности.
В России для лечения АД у детей иммуносупрессирующие препараты используют крайне редко [22]. Чаще больным с тяжелым упорным течением АД, не поддающимся лечению ТКС высокой активности, назначают короткий курс системных глюкокортикостероидов (преднизолон, метипред). Детям их желательно назначать в специализированной клинике. Четких рекомендаций по дозировке пероральных кортикостероидов и надлежащей продолжительности их приема при АД до сих пор нет, в отличие от современных руководств по бронхиальной астме. Обычно пероральные глюкокортикостероиды назначают на начальном этапе лечения обострения АД параллельно с интенсивной топической терапией, во избежание рецидива обострения заболевания при их отмене (синдром отмены) [1, 2, 6].
В целом применения системных кортикостероидов при лечении тяжелой формы АД избегают из-за их системной токсичности [2, 6]. По данным G. Thom и A. Halbert, в Австралии 26% детей, страдающих АД, принимали стероиды перорально [25].
В качестве другого системного вида терапии тяжелой формы АД в литературе рассматривается также внутривенное применение иммуноглобулина, который ранее был с успехом использован в лечении стероидзависимой формы бронхиальной астмы. При анализе данных Medline за 1966–2001 гг. улучшение течения АД было отмечено у 61% больных, получавших внутривенно иммуноглобулин, при этом взрослые пациенты проявляли меньшую чувствительность к терапии (41%), чем дети (90% случаев). Кроме того, продолжительность ремиссии АД после отмены лечения у детей была выше, чем у взрослых, даже если им проводилась лишь монотерапия иммуноглобулином. Однако для подтверждения данного вывода и получения достаточно надежных рекомендаций требуется проведение плацебо-контролируемых исследований.
До недавнего времени большая надежда возлагалась на другой вид иммуномодулирующей терапии, включающей применение рекомбинантных интерферонов [26]. Действительно, исследования эффективности рекомбинантного IFNa и IFNg при средней и тяжелой формах АД подтверждают клиническое улучшение состояния больных и снижение уровня эозинофилов в крови и биоптате атопической кожи [26]. Однако высокая стоимость, а также эффективность лишь в определенной подгруппе больных c АД резко ограничивают использование этих иммуномодуляторов в лечебной практике.
Психологическая поддержка и психотерапия
За рубежом особое место в лечении АД занимает психологическая помощь пациентам и ухаживающим за ними лиц [1, 27–29]. Известно, что зуд, сухость кожи и рецидивирующий характер течения заболевания приводят к физической и эмоциональной дезадаптации пациента и членов его семьи [1].
В отечественной литературе представлено немного исследований, посвященных роли психологической помощи таким больным, равно как и эффективности психофармакологических препаратов в лечении АД.
Взрослым пациентам с АД объясняют, что поражение кожи при АД носит поверхностный характер и не оставляет после себя рубцов. При семейных конфликтах и эмоциональном перенапряжении больного направляют на консультацию к психотерапевту [29].
Таким образом, терапевтический подход при тяжелом упорном течении АД у детей имеет свои особенности. Как видно из представленного обзора, применительно к педиатрии резервные лечебные возможности резко ограничены.
Всех пациентов с эритродермией, тяжелым упорным течением АД, резистентным к стандартной наружной терапии, необходимо госпитализировать в специализированное отделение (желательно аллергологическое) для уточнения диагноза заболевания, клинико-лабораторного обследования и подбора оптимального лечения. Клиническая практика показывает, что во многих случаях исключение воздействия провоцирующих факторов (например, пищевых и/или аэроаллергенов, микробных инфекций) и эмоциональных стрессов в комбинации с интенсивным обучением больного и достижением комплаентности в применении ТКС способствует довольно быстрому уменьшению кожных проявлений АД [1, 2, 27]. Облегчение течения заболевания позволяет в дальнейшем провести больному аллергодиагностику для идентификации возможных аллергенных триггеров.
В заключение хочется отметить, что в случае тяжелого упорного течения АД лечащему врачу следует обратить внимание на такие наиболее распространенные факторы, как:
- правильность диагноза (у пациентов старше 20 лет тяжелую форму АД следует дифференцировать с редкой патологией кожи — грибовидным микозом);
- комплаентность больного; соблюдение им элиминационного режима (например, с исключением пищевых и аэроаллергенов, стрессовых состояний);
- профилактика осложнений микробными инфекциями;
- вовлечение пациента, родителей детей с АД в обучающие мероприятия, которые должны быть нацелены на расширение объема знаний, касающихся данного заболевания, выработку навыков правильного ухода за кожей, повышение удовлетворенности результатами лечения, а также знания тактики лечения в случае ухудшения течения АД [1, 2].
Терапия тяжелого упорного течения АД детского возраста очень сложна из-за ограничений к применению в педиатрии таких методов, как фототерапия, иммуносупрессанты, системные кортикостероиды и ТКС высокой активности. В связи с этим чрезвычайную важность приобретают профилактика прогрессирования течения АД у детей, а также своевременное и правильное лечение данного заболевания.
Литература
- Ellis C., Luger T., Abeck D. et al.//Аллергология. 2003. № 4. C. 50.
- Leung D. // J. Clin. Invest. 2004; 113: 651.
- Hoare C., Li Wan Po A., Williams H.//Health. Technol. Assess. 2000; 4: 1.
- Доказательная медицина. М., 2002.
- Furue M., Terao H., Rikihisa W. et al.//Ibid. 2003; 148: 128.
- Boguniewicz M., Eichenfield L., Hultsch T.//J. Allergy Clin. Immunol. 2003; 112: 140.
- Lebwohl M.//Int. J. Dermatol. 1999; 38: 604.
- Thomas K., Armstromg S., Avery P. et al.//BMJ. 2002; 324: 768.
- Long C., Mills C., Finlay A.//Br. J. Dermatol. 1998; 138: 293.
- Leung D. // Curr. Opin. Pediatr. 2003; 15: 399.
- Ong P., Ohtake T., Brandt C. et al.//N. Eng. J. Med. 2002; 347: 1151.
- Reitamo S., Harper J., Bos J. et al.//Br. J. Dermatol. 2004; 150: 554.
- Nakahara T., Koga T., Fukagawa S., Uchi H., Furue M.//J. Dermatol. 2004; 31(7): 524.
- Gupta A., Chow M.//J. Eur. Acad. Dermatol. Venerol. 2003; 17: 493.
- Wahn U., Bos J., Goodfield M. et al.//Pediatrics. 2002; 110 (1 pt1): e2.
- Norris D. // J. Am. Acad. Dermatol. 2005; 53: 1: 1: 17–25.
- Del Rosso J., Friedlander S.//J. Am. Acad. Dermatol. 2005; 53: 1: 1: 50-58.
- Abramovits W. Ibid., 2005; 53: 1: 1: 70–77.
- Veien N., Busch-Sorensen M., Stausbol-Gron B. Ibid., 2005; 53: 1: 147–149.
- Abeck D., Schmidt T., Fesq H. et al. J. Am. Acad. Dermatol. 2000; 42: 254.
- De Kort W., Van Weelden H.//J. Eur. Acad. Dermatol. Venerol. 2000; 14: 172.
- Короткий Н. Г., Тихомиров А. А.//Педиатрия. 2003. № 1. C. 19.
- Shaffrali F., Colver G., Messenger A. et al.//Am. J. Acad. Dermatol. 2003; 48: 417.
- Fierlbeck G., Benez A.//Br. J. Dermatol. 2001; 144: 638.
- Thom G., Halbert A.//Australas J. Dermatol. 2003; 44: 28.
- Ellis C., Stevens S., Blok B. et al.//Clin. Immunol. 1999; 92: 49.
- Warschburger P., Buchholz H., Petermann F.//Br. J. Dermatol. 2004; 150: 304.
- Elliot B., Luker K.//J. Clin. Nurs. 1997; 6: 241.
- Дж. Мерта. Справочник врача общей практики. М., 1998.
Д. Ш. Мачарадзе, доктор медицинских наук
ДГП № 192, Москва
Врезки:
